Lý thuyết Hóa học 10 bài 23 KNTT
Lý thuyết Hóa lớp 10 bài 23: Ôn tập chương 7 được chúng tôi sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10 sách Kết nối tri thức. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Ôn tập chương 7
A. Lý thuyết Hóa học 10 bài 23
1. Nguyên tử Halogen
- Nhóm halogen gồm: Flo (F), Clo (Cl), Brom (Br), Iot (I), Atatin (At) (Atatin không gặp trong tự nhiên, nó được điều chế nhân tạo trong các lò phản ứng hạt nhân nên được xem xét chủ yếu trong nhóm các nguyên tố phóng xạ).
- Các nguyên tố halogen thuộc nhóm VIIA. Chúng đứng gần cuối chu kì, ngay trước các nguyên tố khí hiếm.
- Nguyên tử các nguyên tố halogen đều có 7e lớp ngoài cùng (ns2 np5)
- Ở trạng thái tự do, 2 nguyên tử halogen góp chung 1e với nhau tạo 1 liên kết cộng hóa trị không cực.
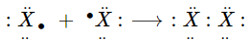
(X là kí hiệu chỉ các nguyên tố halogen)
⟶ Công thức cấu tạo: X−X
⟶ Công thức phân tử: X2
- Liên kết trong phân tử X2 không bền lắm, dễ bị tách thành 2 nguyên tử X.
- Trong phản ứng hóa học, các nguyên tử X dễ thu thêm 1e.
⟹ Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh.
2. Đơn chất Halogen
a. Sự biến đổi tính chất vật lí của các đơn chất
Từ F đến I ta thấy:
- Trạng thái tập hợp: khí ⟶ lỏng ⟶ rắn.
- Màu sắc: đậm dần.
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng dần
b. Sự biến đổi độ âm điện
- Độ âm điện tương đối lớn.
- Giảm dần từ F đến I.
- Trong hợp chất:
+ F có độ âm điện lớn nhất nên chỉ có số oxi hóa −1.
+ Các nguyên tố halogen khác, ngoài số oxi hóa −1 còn có các số oxi hóa +1, +3, +5, +7.
c. Sự biến đổi tính chất hóa học của các đơn chất
- Các đơn chất halogen giống nhau về tính chất hóa học cũng như thành phần và tính chất của các hợp chất do chúng tạo thành (Do lớp e ngoài cùng có cấu hình tương tự nhau (ns2np5) .
- Halogen là những phi kim điển hình. Tính oxi hóa giảm dần từ Flo đến Iot.
- Các đơn chất halogen oxi hóa được:
+ Hầu hết các kim loại ⟶ muối halogenua.
+ H2 ⟶ hợp chất khí không màu hiđro halogenua (khí này tan trong nước tạo dung dịch axit halogenhiđric).
3. Hydrogen Halide
- HCl, HBr, HI tác dụng với kim loại tạo muối và khí H2 : 2xHX + M → MClx + xH2
- HCl, HBr, HI không tác dụng được với Cu, Ag, Au, Pt.
- HCl, HBr, HI khi tác dụng với Fe và Cr chỉ tạo thành Fe2+ và Cr2+.
→ Tính acid tăng dần từ HF (acid yếu) đến HI (acid rất mạnh)
4. Muối Halide
- Hầu hết các muối halide đều dễ tan trong nước, trừ một số muối không tan như silver chloride, silver bromide, silver iodide và một số muối ít tan như lead chroride, lead bromide.
- lon halide, muối halide: Tính khử tăng dần từ fluoride đến iodide.
B. Bài tập minh họa
Bài 1: Trong phương trình MnO2 + HCl → MnCl2 + Cl2 + H2O thì hệ số cân bằng của HCl là bao nhiêu?
A. 1.
B. 2 .
C. 3.
D. 4.
Hướng dẫn giải
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Đáp án D
Bài 2: Những hiđro halogenua có thể thu được khi cho H2SO4 đặc lần lượt tác dụng với các muối NaF, NaCl, NaBr, NaI là
A. HF, HCl, HBr, HI
B. HF, HCl, HBr và một phần HI
C. HF, HCl, HBr
D. HF, HCl
Hướng dẫn giải
2NaF + H2SO4 → Na2SO4 + 2HF
2NaCl + H2SO4 → Na2SO4 + 2HCl
2NaBr + 2H2SO4 → Na2SO4 + Br2 + SO2 + 2H2O
8NaI + 5H2SO4 → 4Na2SO4 + 4I2 + H2S + 4H2O
Đáp án D
Bài 3: Trình bày phương pháp hóa học nhận biết các dung dịch sau: NaNO3 , NaOH, Na2SO4 , NaCl, HCl, H2SO4
Hướng dẫn giải
Trích mỗi dung dịch một ít làm mẫu thử:
Cho quì tím lần lượt vào các mẫu thử trên:
- Mẫu thử làm quì tím hóa xanh là dung dịch NaOH
- Mẫu thử làm quì tím hóa đỏ là dung dịch HCl và H2SO4 (nhóm 1)
- Mẫu thử không làm đổi màu quì tím là NaNO3, Na2SO4 , NaCl (nhóm 2)
Cho dung dịch BaCl2 hoặc dung dịch Ba(NO3)2 hoặc dung dịch Ba(OH) 2 hoặc BaO lần lượt vào hai chất ở nhóm 1
- Mẫu thử tạo kết tủa trắng là H2SO4
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
- Còn lại là dung dịch HCl
Cho dung dịch BaCl2 hoặc dung dịch Ba(NO3)2 hoặc dung dịch Ba(OH) 2 lần lượt vào hai chất ở nhóm 2.
- Mẫu thử nào tọa kết tủa trắng là Na2SO4
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
- Hai mẫu thử còn lại không có hiện tượng gì
Cho dung dịch AgNO3 lần lượt vào hai mẫu thử còn lại. Mẫu thử nào kết tủa trắng là NaCl, còn lại là NaNO3
AgNO3 + NaCl → AgCl↓ + NaNO3
C. Trắc nghiệm Hóa học 10 bài 23
------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Lý thuyết Hóa học 10 bài 23: Ôn tập chương 7 KNTT Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.









