Giải bài tập Hóa 10 Bài 22: Clo
Giải bài tập Hóa 10: Clo
Giải bài tập Hóa 10 bài 22: Clo,được VnDoc biên soạn hướng dẫn giải chi tiết các dạng câu hỏi bài tập sách giáo khoa hóa 10 bài 22 Clo. Chắc chắn tài liệu sẽ là nguồn thông tin hữu ích để giúp các bạn học sinh nắm chắc phương pháp giải một cách đơn giản hơn. Mời thầy cô cùng các bạn học sinh tham khảo.
A. Tóm tắt lý thuyết hóa 10 bài 22
I. Trạng thái tự nhiên
Chỉ tồn tại trong tự nhiên ở dạng hợp chất, chủ yếu trong muối natriclorua (muối biển và muối mỏ); HCl có trong dịch vị dạ dày của người và động vật
Trong nước biển, clo chiếm khoảng 2% khối lượng
II. Tính chất vật lý
Ở điều kiện thường, Clo là chất khí màu vàng lục, mùi sốc, rất độc
Nặng gấp 2,5 lần không khí và tan trong nước. Dung dịch của khí Clo trong nước gọi là nước Clo có màu vàng nhạt
Khí Clo tan nhiều trong các dung môi hữu cơ như benzene, etanol, hexan
III. Tính chất hóa học
Tính chất hóa học cơ bản của Clo là tính oxi hóa mạnh
1. Tác dụng với kim loại
Clo tác dụng với hầu hết các kim loại sinh ra muối clorua
2Na + Cl2 → 2NaCl
2. Tác dụng với hiđro
Ở nhiệt độ thường, khí clo không phản ứng với hiđro
H2 + Cl2 → HCl
3. Tác dụng với nước
Một phần khí Clo tác dụng với nước tạo ra hỗn hợp axit clohiđric và axit hipocloro có tính tẩy màu mạnh do có HClO là chất oxh rất mạnh.
Cl2 + H2O ⇄ HCl + HClO
=> Khi Clo tan trong nước, diễn ra cả hiện tượng vật lý và hiện tượng hóa học.
4. Tác dụng với dung dịch kiềm
Cl2 + 2NaOH → NaCl + NaClO + H2O
5. Tác dụng với một số hợp chất có tính khử
Cl2 + 2NaBr → 2NaCl + Br2
* Nhận xét:
Khi tham gia phản ứng với H2, kim loại và các chất khử, clo đóng vai trò là chất OXH
Khi tham gia phản ứng với H2O và dung dịch kiềm, Clo đóng vai trò vừa là chất OXH vừa là chất Khử.
IV. Điều chế
1.Trong phòng thí nghiệm
Dùng các chất có tính oxi hóa mạnh tác dụng với axit HCl đặc
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2. Trong công nghiệp
Điện phân dung dịch bão hòa muối ăn trong nước để sản xuất xút, đồng thời thu được khí Clo và hiđro
2NaCl + 2H2O → 2NaOH + H2 + Cl2 (có màng ngăn)
B. Giải bài tập hóa 10 bài 22
Bài 1 trang 101 sgk Hóa 10
Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách oxi hóa hợp chất nào sau đây:
A. NaCl.
B. HCl.
C. KClO3.
D. KMnO4.
Đáp án hướng dẫn giải bài tập
Đáp án B. HCl đúng.
Bài 2 trang 101 sgk Hóa 10
Cho biết tính chất hóa học cơ bản của nguyên tố clo. Giải thích vì sao nguyên tố clo có tính chất hóa học cơ bản đó? Cho thí dụ minh họa.
Đáp án hướng dẫn giải bài tập
Tính chất hóa học cơ bản của clo: Clo là chất oxi hóa mạnh.
Tác dụng với kim loại: clo oxi hóa trực tiếp hầu hết các kim loại tạo muối clorua, phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, tốc độ nhanh, tỏa nhiều nhiệt.
2Fe + 3Cl2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
\(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
Tác dụng với hiđro: Phản ứng xảy ra khi chiếu sáng bởi ánh sáng mặt trời:
H2 + Cl2 → 2HCl.
Tác dụng với nước:
Trong phản ứng với nước, clo vừa là chất oxi hóa vừa là chất khử.
Cl2 + H2O ⇆ HCl + HClO
Sở dĩ có những tính chất hóa học cơ bản trên vì khi tham gia phản ứng, nguyên tử clo dễ nhận thêm 1 electron để thành ion Cl-. Vì vậy tính chất hóa học cơ bản của clo là tính oxi hóa mạnh.
Bài 3 trang 101 sgk Hóa 10
Dẫn khi clo vào nước, xảy ra hiện tượng vật lí hay hóa học? Giải thích.
Đáp án hướng dẫn giải bài tập
Dẫn khí clo vào nước, xảy ra vừa là hiện tượng vật lí vừa là hiện tượng hóa học. Khi tan vào nước, một phần clo tác dụng với nước.
Cl2 + H2O ⇆ HCl + HClO.
Bài 4 trang 101 sgk Hóa 10
Nêu những ứng dụng thực tế của khí clo.
Đáp án hướng dẫn giải bài tập
Những ứng dụng thực tế của clo:
1. Khí clo được dùng để tiệt trùng nước sinh hoạt, hòa tan vào nước một lượng nhỏ khí clo để diệt vi khuẩn gây bệnh.
2. Khí clo được dùng để sản xuất các chất tẩy trắng, sát trùng như nước Gia – ven, clorua vôi và sản xuất những hóa chất trong công nghiệp như HCl, KClO3.
3. Một lượng lớn clo được dùng để chế những dung môi công nghiệp như cacbon tetra clorua (CCl4) sản xuất nhiều chất polime như nhựa PVC, cao su tổng hợp, tơ clorin v.v ...
Bài 5 trang 101 sgk Hóa 10
Cân bằng các phương trình phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron:
a) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O.
b) HNO3 + HCl → NO2 + Cl2 + H2O.
c) HClO3 + HCl → Cl2 + H2O.
d) PbO2 + HCl → PbCl2 + Cl2 + H2O.
Đáp án hướng dẫn giải bài tập
Cân bằng các phản ứng oxi hóa - khử sau bằng phương pháp thăng bằng electron:
a) 2KMn+7O4 + 16H−1Cl → 2KCl + 2Mn+2Cl2 + 5Cl02 + 8H2O
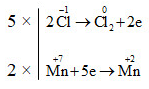
b) 6H−1Cl + 2HN+5O3 → 2N+2O+ 3Cl02 + 4H2O
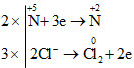
c) 5H−1Cl + HCl+5O3 → 3Cl02+ 3H2O
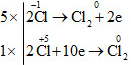
d) Pb+ 4O2 + 4H−1Cl → Pb+2Cl2 + Cl02 + 2H2O
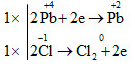
Bài 6 trang 101 sgk Hóa 10
Tại sao trong công nghiệp người ta dùng phương pháp điện phân dung dịch NaCl bão hòa chứ không dùng phản ứng oxi hóa – khử giữa các hóa chất để điều chế khí clo?
Đáp án hướng dẫn giải bài tập
rong công nghiệp không dùng phản ứng oxi hóa khử giữa các hóa chất để điều chế clo vì giá thành sản phẩm cao. Còn NaCl có sẵn trong nước biển nên giá thành rẻ.
2NaCl + H2O → 2NaOH + Cl2 + H2 (điện phân dung dịch, màng ngăn xốp)
Bài 7 trang 101 sgk Hóa 10
Cần bao nhiêu gam KMnO4 và bao nhiêu ml dung dịch axit clohiđric 1M để điều chế khí clo tác dụng với sắt, tạo nên 16,25 gam FeCl3?
Đáp án hướng dẫn giải bài tập
nFeCl3 = 16,25 /162,5 = 0,1 mol.
Phương trình hóa học của phản ứng:
3Cl2 + 2Fe → 2FeCl3.
nCl2 = 0,1 x 3 /2 = 0,15 mol.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
nKMnO4 = 0,15 x 2 / 5 = 0,06 mol.
nHCl = 0,15 x 16 / 0,5 = 0,48 mol.
mKMnO4 cần = 0,06 x 158= 9,48g.
Vdd HCl = 0,48/1 = 0,48lít hay 480ml
Trong công nghiệp không dùng phản ứng oxi hóa – khử giữa các hóa chất để điều chế clo vì giá thành sản phẩm rất cao.
>> Mời các bạn tham khảo thêm giải hóa 10 bài tiếp theo tại: Giải bài tập Hóa 10 Bài 23: Hiđro clorua Axit clohiđric và muối clorua
C. Trắc nghiệm Hóa 10 bài 22 Clo
Câu 1: Cho clo vào nước, thu được nước clo. Biết clo tác dụng không hoàn toàn với nước. Nước clo là hỗn hợp gồm các chất:
A. HCl, HClO
B. HClO, Cl2, H2O
C. H2O, HCl, HClO
D. H2O, HCl, HClO, Cl2
Câu 2: Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. Điện phân nóng chảy NaCl.
B. Cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. Điện phân dung dịch NaCl có màng ngăn.
D. Cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Câu 3: Cho kim loại M tác dụng với Cl2 được muối X; cho kim lọa M tác dụng với dung dịch HCl được muối Y. Nếu cho dung dịch muối Y tác dụng với Cl2 cũng thu được muối X. Kim loại M có thể là
A. Mg
B. Zn
C. Al
D. Fe
Câu 4: Chất dung để làm khô khí Cl2 ẩm là
A. dung dịch H2SO4 đậm đặc.
B. Na2SO3 khan.
C. CaO.
D. Dung dịch NaOH đặc.
>> Chi tiết đáp án bộ câu hỏi trắc nghiệm Hóa 10 bài 22 Clo tại: Trắc nghiệm Hóa học 10 bài 22: Clo
---------------------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa 10 Bài 22: Clo. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Hóa học lớp 10, Thi thpt Quốc gia môn Văn, Thi thpt Quốc gia môn Lịch sử, Thi thpt Quốc gia môn Địa lý, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.










