Cho biết khối lượng nguyên tử (theo u) của các nguyên tố:
H = 1; Li = 7; Be = 9; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Br = 80; Rb = 85,5; Ag = 108; I =127; Ba = 137.
Câu 1:
Gluxit nào sau đây có phản ứng tráng gương?
Câu 2:
Hidro hóa hoàn toàn CH2=CHCHO thì thu được chất nào?
Câu 3:
Cho các dung dịch: HCl, NaCl, HNO3 (loãng), CuSO4. Fe không tác dụng được với dung dịch nào?
Câu 4:
Để giảm thiểu nguy hiểm cho người điều khiển phương tiện và người tham gia giao thông, các loại kính chắn gió của ôtô thường được làm bằng thủy tinh hữu cơ. Polime nào sau đây là thành phần chính của thủy tinh hữu cơ:
Câu 5:
Hiện nay khí metan (CH4) được dùng để thay thế một phần cho các nhiên liệu hóa thạch (dầu mỏ, than đá…). Người ta sản xuất khí metan bằng cách nào?
Câu 6:
Tách nước 2-metylbutan-2-ol bằng H2SO4 đặc ở 1700C thu được sản phẩm chính nào?
Câu 7:
Lấy 6,0 gam anđehit fomic tác dụng với dung dịch AgNO3 trong NH3 dư thì thu được m gam Ag. Giá trị của m là:
Câu 8:
Chất nào sau đây không tham gia phản ứng tráng gương?
Câu 9:
Dung dịch CuSO4 loãng được dùng làm thưốc diệt nấm. Để điều chế 400 gam dung dịch CuSO4 5% thì khối lượng CuSO4.5H2O cần dùng là:
Câu 10:
Khử hoàn toàn m gam Fe2O3 bằng CO dư ở nhiệt độ cao thu được 1,12 gam Fe. Giá trị m là:
Câu 11:
Lấy 7,8 gam kali tác dụng hoàn toàn với nước thu được V lít khí (đktc). Giá trị của V là:
Câu 12:
Chất nào sau đây là chất điện li yếu?
Câu 13:
Cho các chất: phenol, stiren, benzen, anilin, glixerol. Số chất tác dụng được với dung dịch nước brom ở điều kiện thường là:
Câu 14:
Trong các kim loại sau đây, kim loại có tính khử mạnh nhất là:
Câu 15:
Ancol etylic và phenol đều có phản ứng với:
Câu 16: Cho hỗn hợp Fe, Mg vào dung dịch AgNO3 và Cu(NO3)2 thì thu được dung dịch A và 1 kim loại. Kim loại thu được sau phản ứng là:
Câu 17: Nguyên tử X có điện tích hạt nhân là 15+. Ở trạng thái cơ bản X có bao nhiêu electron ở lớp ngoài cùng?
Câu 18: Trong số các kim loại Al, Zn, Fe, Ag. Kim loại nào không tác dụng được với O2 ở nhiệt độ thường?
Câu 19: Trong các chất: H2SO4, Ba(OH)2, NaCl, KHSO4. Dung dịch chất nào (nồng độ khoảng 0,1M) làm quỳ tím chuyển thành màu xanh?
Câu 20: Phản ứng nào sau đây lưu huỳnh không thể hiện tính khử.
Câu 21: Aminoaxit nào sau đây có phân tử khối lớn nhất?
Câu 22: Thành phần chính của phân supephotphat kép là:
Câu 23: Lấy 1,76 gam một este đơn chức X tác dụng vừa đủ với 200ml dung dịch NaOH 0,1M, kết thúc phản ứng thu được 1,64 gam muối. X là:
Câu 24: Đốt cháy hoàn toàn 1 mol CH3COOH thì tổng khối lượng CO�2 và H2O thu được là:
Câu 25: Phát biểu nào sau đây sai?
Câu 26: Chất nào sau đây thuộc dãy đồng đẳng anken:
Câu 27: Lần lượt cho một mẫu Ba và các dung dịch K2SO4, NaHCO3, HNO3, NH4Cl. Có bao nhiêu trường hợp xuất hiện kết tủa?
Câu 28: Hợp chất nào sau đây là hợp chất ion?
Câu 29: Chất nào sau đây tác dụng được với NaOH?
Câu 30:
Cho các chất: HCOO-CH3, CH3-COOH, CH3-COOCH=CH2, CH3-CH2-CHO. Số chất trong dãy thuộc loại este là:
Câu 31: Cho các chuyển hóa sau:
X + H2O ---xt, to---> Y;
Y + Br2 + H2O ----> Axit gluconic + HBr
Axit gluconic + NaHCO3 -----> Z + Natri gluconat + H2O
Z + H2O ----as, diep luc--->X + E
Các chất X, Y lần lượt là:
Câu 32: Cho 6,9 gam hỗn hợp X gồm axit fomic và ancol etylic tác dụng với Na dư được V lít H2 (đkc). Giá trị của V là:
Câu 33: Dung dịch X chứa 0,1 mol Ca2+ ; 0,2 mol Mg2+ ; 0,4 mol Cl- và a mol HCO3-. Đun dung dịch X đến cạn thu được muối khan có khối lượng là:
Câu 34: Cho hỗn hợp X gồm Fe, Cu, Fe2O�3 và CuO vào 90 ml dung dịch HCl 1M, thu được dung dịch Y và kim loại Z. Cho Y tác dụng hết với KOH dư, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi được m gam chất rắn. Giá trị của m là:
Câu 35: Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
Câu 36: Hòa tan m gam hỗn hợp X gồm NaH2PO4, Na2HPO4 và Na3PO4 vào nước dư thu được dung dịch Y. Trung hòa hoàn toàn Y cần 50 ml dung dịch KOH 1M, thu được dung dịch Z. Cho Z tác dụng hết với dung dịch AgNO3 dư thu được 16,76 gam kết tủa. Giá trị m là:
Câu 37: Cho X, Y, Z, T là các chất khác nhau trong số 4 chất HCOOH; CH
3COOH; HCl; C
6H
5OH (phenol) và pH của các dung dịch trên được ghi trong bảng sau:
| Chất |
X |
Y |
Z |
T |
| pH (dung dịch nồng độ 0,01M, 25oC) |
6,48 |
3,22 |
2,00 |
3,45 |
Nhận xét nào sau đây đúng?
Câu 38: Cho các phương trình phản ứng:
(1) dung dịch FeCl3 + Cu → (5) K + H2O →
(2) Hg + S → (6) H2S + O2 dư →
(3) F2 + H2O → (7) SO2 + dung dịch Br2 →
(4) MnO2 + HCl đặc → (8) Mg + dung dịch HCl →
Trong các phản ứng trên, số phản ứng tạo đơn chất là:
Câu 39: Amino axit X trong phân tử có chứa một nhóm –NH2 và một nhóm –COOH. Cho 26,7 gam X phản ứng với lượng dư dung dịch H2SO4, thu được dung dịch Y chứa 41,4 gam muối. Công thức của X là:
Câu 40: Hỗn hợp A gồm axit axetic, ancol metylic và este đơn chức X. Đốt cháy hoàn toàn 2,44 gam hỗn hợp A cần 0,09 mol O2, thu được 1,8 gam H2O. Mặt khác, nếu lấy 0,1 mol A tác dụng với Natri dư thì thu được 0,672 lít H2 (đktc). Phần trăm số mol axit axetic trong A là:
Câu 41: Cho m gam hỗn hợp X gồm Cu và Fe2O3 vào dung dịch HCl, sau phản ứng hoàn toàn thu được dung dịch Y chứa hai chất tan và còn lại 0,552m gam chất rắn chưa tan. Tách bỏ phần chưa tan, cho dung dịch AgNO3 dư vào dung dịch Y thu được 107,7 gam kết tủa. Giá trị của m là:
Câu 42: Hỗn hợp khí X gồm CH4, C2H2, C2H4, C3H6. Đun nóng 12,8 gam X với 0,3 mol H2 xúc tác bột Ni một thời gian, thu được hỗn hợp khí Y có tỉ khối so với He bằng 5. Đốt cháy hoàn toàn Y, thu được tỉ lệ khối lượng CO2 và H2O bằng 22/13. Nếu sục hỗn hợp Y vào dung dịch AgNO3 trong NH3 dư thì thu được m gam kết tủa và hỗn hợp khí Z. Khí Z phản ứng vừa đủ với 300 ml dung dịch Br2 0,5M. Giá trị của m là:
Câu 43: Hỗn hợp X gồm Fe, Mg, MgO, FeO, Fe2O3, Fe3O4 trong đó Oxi chiếm 23,43% về khối lượng. Hòa tan hết 38,24 gam X trong dung dịch chứa a mol HCl và b mol KNO3 thu được dung dịch Y chỉ chứa các muối trung hòa và 1,12 lít (đktc) hỗn hợp 2 khí gồm N2 và N2O. Cho từ từ dung dịch AgNO3 2M vào Y, đến khi lượng kết tủa đạt cực đại thì thấy dùng vừa hết 940 ml, đem cô cạn dung dịch tạo thành thu được m gam rắn, nung phần rắn này trong chân không thấy khối lượng giảm 103,24 gam và thoát ra 55,44 lít hỗn hợp khí và hơi. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với:
Câu 44: Điện phân 1 lít dung dịch X gồm Cu(NO�3�)�2 0,6M và FeCl3 0,4M đến khi anot thoát ra 17,92 lít khí (đktc) thì dừng lại. Lấy catot ra khỏi bình điện phân, khuấy đều dung dịch để phản ứng xẩy ra hoàn toàn� thì thu được dung dịch Y. Giả thiết kim loại sinh ra đều bám lên catot, sản phẩm khử của N+5 (nếu có) là NO duy nhất. Giá trị (mX –mY) gần nhất là:
Câu 45: Đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm axit hidroxiaxetic( HO-CH2-COOH), axit acrylic (CH2=CH-COOH), axit succinic (HOOC-CH2-CH2-COOH), etylen glycol (HO-CH2-CH2-OH), axit terephtalic (HOOC-C6H4-COOH) (trong đó etylen glicol và axit terephtalic có cùng số mol). Sản phẩm cháy được hấp thụ hoàn toàn vào 300 ml dung dịch Ba(OH)2 1M, thu được 39,4 gam kết tủa đồng thời khối lượng dung dịch giảm 16,94 gam. Khối lượng của hỗn hợp X là:
Câu 46: X là hỗn hợp gồm Al và 2 oxit sắt, trong đó oxi chiếm 13,71% khối lượng hỗn hợp. Tiến hành nhiệt nhôm (không có không khí) m gam rắn X được hỗn hợp rắn Y. Cho Y vào dung dịch NaOH dư thấy có H2 thoát ra và có 1,2 mol NaOH tham gia phản ứng, chất rắn còn lại không tan có khối lượng là 28 gam. Biết các phản ứng xảy ra hoàn toàn. Giá trị m là:
Câu 47: Nhỏ từ từ dung dịch đến dư Ba(OH)
2 0,2M vào 100 ml dung dịch A chứa Al
2(SO
4)
3 xM. Mối quan hệ giữa khối lượng kết tủa và số mol OH
- được biểu diễn bằng đồ thị sau:
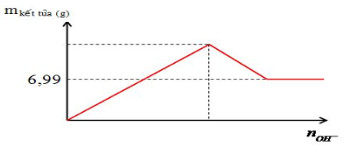
Nếu cho 100ml dung dịch hỗn hợp Ba(OH)
2 0,2M và NaOH 0,3M vào 100ml dung dịch A thì khối lượng kết tủa thu được là bao nhiêu?
Câu 48: Hợp chất hữu cơ X có công thức C2H8N2O4. Khi cho 3,1 gam X tác dụng với 50ml dung dịch NaOH 1,5M thu được 1,12 lít( đktc) khí X làm xanh quỳ tím ẩm. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn khan. Giá trị của m là:
Câu 49: Đun nóng 0,15 mol hỗn hợp X gồm hai peptit mạch hở (đều tạo bởi glyxin và axit glutamic) với 850 ml dung dịch KOH 1M (vừa đủ). Kết thúc các phản ứng, cô cạn dung dịch thu được 95,15 gam muối khan. Khối lượng của 0,1 mol X là:
Câu 50: Hỗn hợp X gồm 2 chất hữu cơ đơn chức A và B (chứa C, H, O và đều có phân tử khối lớn hơn 50). Lấy m gam X tác dụng vừa đủ với dd NaOH, sau phản ứng hoàn toàn thu được sản phẩm là dd Y chỉ chứa hai muối, trong đó có một muối chứa 19,83% natri về khối lượng. Chia dung dịch Y thành 2 phần bằng nhau. Phần 1 đem thực hiện phản ứng tráng bạc, thu được tối đa 16,2 gam Ag. Phần 2 đem cô cạn rồi đốt cháy hoàn toàn thu được CO2, H2O và 10,6 gam Na2CO3. Giá trị m là:


