Wiki tính chất hóa học của Nhôm
Wiki tính chất hóa học của Nhôm được VnDoc sưu tầm và đăng tải, tổng hợp các câu hỏi lí thuyết trong chương trình giảng dạy môn Hóa học. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Tính chất hóa học của Nhôm
I. Định nghĩa
- Nhôm là tên một nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Al. Nhôm là nguyên tố phổ biến thứ 3, và là kim loại phổ biến nhất trong vỏ Trái Đất.
- Kí hiệu: Al
- Cấu hình electron: 1s22s22p63s23p1 hay [Ne]3s223p1
- Số hiệu nguyên tử: 13
- Khối lượng nguyên tử: 27 g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: số 13
+ Nhóm: IIIA
+ Chu kì: 3
- Đồng vị: Thường chỉ gặp 27Al
- Độ âm điện: 1,61
I. Tính chất vật lý & nhận biết
1. Tính chất vật lí:
- Nhôm là kim loại nhẹ (khối lượng riêng 2,7g/cm3).
- Màu trắng bạc, nóng chảy ở nhiệt độ không cao lắm (660oC).
- Nhôm mềm, dễ kéo sợi và dễ dát mỏng.
- Nhôm dẫn điện và dẫn nhiệt tốt.
2. Nhận biết
Cho Al phản ứng với dung dịch NaOH (hoặc KOH). Hiện tượng quan sát được: Nhôm tan dần, sinh ra khí không màu.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
III. Tính chất hóa học
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
1. Tác dụng với phi kim
a) Tác dụng với oxi
![]()
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
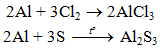
2. Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
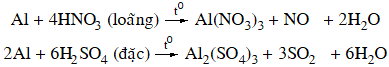
Nhôm bị thụ động hoá trong dung dịch HNO3đặc, nguội hoặc H2SO4 đặc nguội.
3. Tác dụng với oxit kim loại( Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
![]()
4. Tác dụng với nước
- Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
6. Tác dụng với dung dịch muối
- Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
IV. Trạng thái tự nhiên
- Trong tự nhiên chỉ tồn tại dưới dạng hợp chất.
- Có trong: Đất sét (Al2O3.2SiO2.2H2O), mica (K2O.Al2O2.6H2O), boxit (Al2O3.2H2O), criolit (3.NaF.AlF3)...
V. Điều chế
- Nguyên liệu là quặng Boxit (Al2O3.2H2O).
- Điện phân nóng chảy oxit nhôm trong criolit.
![]()
VI. Ứng dụng
-Hợp kim nhôm, nhẹ và bền, được dùng để chế tạo các chi tiết của phương tiện vận tải (ô tô, máy bay, xe tải, toa xe tàu hỏa, tàu biển, v.v.)
-Nhôm và hợp kim của nhôm được dùng trong xây dựng nhà cửa và trang trí nội thất.
-Nhôm được dùng làm dây dẫn điện thay cho đồng.
-Dùng làm dụng cụ nhà bếp.
-Bột nhôm trộn với bột sắt oxit (hỗn hợp tecmit) được dùng để hàn đường ray.
VII. Các hợp chất quan trọng của Al
-Nhôm oxit (Al2O3)
-Nhôm hiđroxit (Al(OH)3)
-Nhôm sunfat (Al2(SO4)2)
-Phèn chua: K2SO4.Al2(SO4)3.24H2O
Wiki tính chất hóa học của Nhôm trên đây được VnDoc sưu tầm và giới thiệu nhằm giúp các em học sinh hiểu rõ hơn về tính chất hóa học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đã học trong chương trình Hóa học.


