Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư), sinh ra V lít khí NO2
Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư), sinh ra V lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra? là bài tập cơ bản điển hình cho chuyên đề axit nitric. Giúp các bạn nắm được kiến thức đã học vận dụng làm bài tập, tiền đề cho các bài hóa nâng cao Hóa học lớp 11.
Cho 5,6 g Fe tác dụng dung dịch HNO3 (dư)
1. Axit nitric đặc tác dụng với kim loại
Axit nitric tác dụng với kim loại trừ Au và Pt tạo muối và nhiều sản phẩm oxi hóa khác nhau như NO2, NO, N2O ,N2, NH4NO3
Sản phẩm khử của N+5 sinh ra tùy thuộc vào độ mạnh yếu của kim loại và nồng độ của dung dịch axit, thông thường thì:
- Dung dịch HNO3 đặc tác dụng với kim loại → NO2;
- Dung dịch HNO3 loãng tác dụng với kim loại khử yếu (như: Cu, Pb, Ag,..) → NO;
- Dung dịch HNO3 loãng tác dụng với kim loại mạnh (như: Al, Mg, Zn,...) thì N bị khử xuống mức càng sâu → (N2, N2O, NH4NO3).
Cách phân biệt các khí sản phẩm sinh ra
- N2O là khí gây cười
- N2 không duy trì sự sống, sự cháy
- NO2 có màu nâu đỏ
- NO khí không màu nhưng bị oxit hóa thành NO2 màu nâu đỏ
- NH4NO3 không sinh ra ở dạng khí, khi cho kiềm vào kim loại thấy có mùi khai amoniac NH3
NH4NO3 + NaOH → NaNO3 +NH3 + H2O
Ví dụ:
- 8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O (1)
- Fe + 6HNO3đặc nóng → Fe(NO3)3 + 3NO2 + 3H2O (2)
- Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O (3)
Khi giải bài tập về phần axit nitric đặc nóng thường vận dụng bảo toàn e và bảo toàn nguyên tố.
Chú ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc, nguội.
2. Axit nitric đặc tác dụng với phi kim
C + 4HNO3đặc nóng → CO2 + 4NO2 + 2H2O
3. Axit nitric đặc tác dụng với các chất khử khác
4HNO3 + FeCO3 → Fe(NO3)3 + NO2↑ + 2H2O + CO2↑
4. Nguyên tắc giải bài tập
Dùng định luật bảo toàn e
Mo → Mn+ + ne => ne nhường = ne nhận
N+5 + (5-x)e → N+5
Đặc biệt:
+ Nếu phản ứng tạo ra nhiều sản phẩm khử N thì ne nhường = Σne nhận
+ Nếu có nhiều chất khử tham gia phản ứng Σne nhường = ne nhận
Trong một số trường hợp cần kết hợp với định luật bảo toàn điện tích (tổng điện tích dương = tổng điện tích âm) và định luật bảo toàn nguyên tố
Có thể sử dụng phương trình ion – electron hoặc các bán phản ứng để biểu diễn các quá trình.
+ Đặc biệt trong trường hợp kim loại tác dụng với axit HNO3 ta có:
nHNO3 (pư) = 2nNO2 = 4nNO = 10 nN2O = 12nN2 = 10nNH4NO3
nNO3- (trong muối) = nNO2 = 3nNO = 8nN2O = 10nN2 = 8nNH4NO3
Nếu hỗn hợp gồm cả kim loại và oxit kim loại phản ứng với HNO3 (và giả sử tạo ra khí NO) thì:
nHNO3 (pư) = 4nNO + 2nO (trong oxit KL)
5. Bài tập trắc nghiệm minh họa
Ví dụ 1: Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư). Sau phản ứng sinh ra V lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra?
A. 6,72 lít B. 13,44 lít C. 3,36 lít D. 10,08 lít
Đáp án hướng dẫn giải chi tiết
Phương trình hóa học
Fe+ 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
nFe= 5,6/56 = 0,1 mol
Theo phương trình
→ nNO2 = 3nFe=0,1 x 0,3= 0,3 mol
→ V = 0,3 x 22,4 = 6,72 lít
Lưu ý: Xem phương trình số (2)
Ví dụ 2. Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 loãng (dư). Sau phản ứng sinh ra V lít khí N2O (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra?
A. 2,24 lít B. 1,68 lít C. 3,36 lít D. 0,84 lít
Đáp án hướng dẫn giải chi tiết
Phương trình hóa học
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O
nFe = 5,6/56 = 0,1 mol
Theo phương trình
→ nN2O = 3/8nFe= 0,1 x 3/8 = 0,0375 mol
→ V = 0,0375 x 22,4 = 0,84 lít
Lưu ý: Xem phương trình số (1)
Ví dụ 3. Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư). Sau phản ứng sản phẩm sinh ra NO sản phẩm khử duy nhất. Tính khối lương muối thu được?
A. 2,24 lít B. 3,36 lít C. 4,48 lít D. 6,78 lít
Đáp án hướng dẫn giải chi tiết
Phương trình hóa học
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
nFe = 5,6/56 = 0,1 mol
Theo phương trình
→ nNO = nFe= 0,1 x 1 = 0,1 mol
→ V = 0,1 x 22,4 = 2,24 lít
Lưu ý: Xem phương trình số (3)
Ví dụ 4. Hoà tan hoàn toàn m g bột Cu trong 800 g dung dịch HNO3 được dung dịch Y và 2,24 lit khí NO (đktc). Y tác dụng vừa đủ với 300 ml dung dịch NaOH 2M được kết tủa R. Sau khi nung R đến khối lượng không đổi thu được 20 g chất rắn.
a. Tính khối lượng Cu ban đầu.
b. Tính khối lượng các chất trong Y và nồng độ % của dung dịch HNO3 đã dùng
Đáp án hướng dẫn giải chi tiết
nNO = 2,24/22,4 = 0,1 mol; nNaOH = 0,3.0,2 = 0,06 mol
a. Khi cho Y tác dụng với dung dịch NaOH thu được kết tủa R chỉ chứa Cu(OH)2.
Chất rắn thu được khi nung là CuO => nCuO = 20/80 = 0,25 mol
=> nCu(OH )2 = nCuO = 0,25 mol.
Theo định luật bảo toàn nguyên tố:
nCu (ban đầu) = nCu (trong CuO) = 0,25 mol => mCu = 0,25.64 = 16 g
b. Trong X, nCu2+ = nCu(OH)2 = 0,25 mol => mCu(NO3)2 = 188.0,25 = 47 g
Cu → Cu2+ + 2e
0,25 mol 0,5 mol
Mà: N+5 + 3e → N+2
0,3 mol 0,1 mol
Vậy chứng tỏ phản ứng của Cu và HNO3 phải tạo ra NH4NO3.
ne (Cu nhường) = Σne nhận = 0,5 mol => ne nhận N+5 →N-3 = 0,5 – 0,3 = 0,2 mol
N+5 + 8e → N-3
0,2 mol 0,025 mol
nNH4NO3 = 0,025 mol => mNH4NO3 = 80.0,025 = 2 g
Theo định luật bảo toàn nguyên tố:
n HNO3 pư = nN (trong Cu(NO3)2 ) + nN (trong NO) + nN (trong NH4NO3)
= 2nCu(NO3)2 + nNO + 2nNH4NO3 = 0,65 mol
Nếu sử dụng công thức tính nhanh ở trên ta có:
nHNO3 pư = 4.nNO + 10.nNH4NO3 = 4.0,1 + 10.0,25 = 0,65 mol
mHNO3 = 63.0,65 = 40,95 g => C% = 40,95/800.100% = 5,12%
Ví dụ 5. Cho m gam Mg, Zn, Al, Cu tác dụng hết với HNO3 thu được 16,8 lít hỗn hợp khí Z: NO, NO2 ,N2, N2O (không tạo muối amoni). Số mol NO và N2O bằng nhau. Tỉ khối của Z so với H2 là 18,5. Số mol HNO3 phản ứng
Đáp án hướng dẫn giải
NO và N2O có số mol bằng nhau => quy đổi 2 khí này thành: NO2, N2
Hỗn hợp khí Z coi như gồm N2 (x mol), NO2 (y mol)
MZ = 18,5.2= 37
nZ = V/22,4 = 0,75 mol
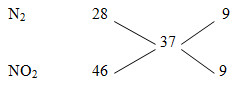
nN2/nNO2= 9/9 = 1/1
=> nN2 = nNO2 = 0,75/2 = 0,375 mol
Gọi công thức chung của hỗn hợp kim loại là M, hóa trị n
M0 → +ne
a na
2N+5 + 10e → N20
0,75 ← 3,75 ← 0,375
N+5 +1e → N+4
0,375 ← 0,375 ← 0,375
Bảo toàn e: na = 3,75 + 0,375= 4,125 => na = 4,125
nHNO3 = n. nFe(NO3)n + nNO2 + 2nN2 = 4,125 + 0,375 +2.0,375 = 5,25 mol
Ví dụ 6. Thể tích dung dịch HNO3 1M loãng ít nhất cần dùng để hoà tan hoàn toàn 9 gam hỗn hợp gồm Fe và Cu trộn theo tỉ lệ mol 1 : 1 là (biết phản ứng tạo chất khử duy nhất là NO)
A.1,0 lít B. 0,6 lít C.0,8 lít D.0,4 lít
Đáp án hướng dẫn giải chi tiết
Gọi nFe = nCu = a mol. Theo đầu bài ta có
=> 56a + 64a = 9
=> a = 0,075 mol
Do thể tích dung dịch HNO3 cần dùng ít nhất, nên sắt sẽ bị hòa tan hết bởi HNO3 vừa đủ tạo muối Fe3+, Cu tác dụng vừa đủ với Fe3+ tạo muối Cu2+ và Fe2+ => sau phản ứng chỉ thu được hai muối Cu(NO3)2 và Fe(NO3)2
Fe → Fe2+ + 2e
0,075 → 0,15
Cu → Cu2+ + 2e
0,075 → 0,15
=> ∑ne cho = 2.(0,075 + 0,075) = 0,3 mol
=> ne nhận = 3.nNO = 0,3 => nNO = 0,1 mol
Ta có:nNO − 3nNO3− = ne cho = 0,3 mol
Bảo toàn nguyên tố N:
nHNO3 = nNO3− + nNO= 0,3 + 0,1 = 0,4 mol
=> VHNO3 = 0,4/1 = 0,4 lít
Ví dụ 7. Hoà tan hết hỗn hợp A gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 56,7gam Zn(NO3)2 và 4 gam NH4NO3. Phần trăm khối lượng Zn trong A là
A. 33,33% B. 66,67% C. 61,61% D. 50,00%
Đáp án hướng dẫn giải chi tiết
Theo đề bài ta có:
nZn(NO3)2 = 0,3 mol;
nNH4NO3 = 0,05 mol
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Bảo toàn e: 2.nZn = 8.nNH4NO3 => nZn = 4.0,05 = 0,2 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO => nZnO = 0,3 – 0,2 = 0,1 mol
%mZn = (0,2.65)/(0,2.65 + 0,1.81).100% = 61,61%
Ví dụ 8: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất) (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
A. 38,72
B. 35,50
C. 49,09
D. 34,36
Đáp án hướng dẫn giải chi tiết
Xem hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 chỉ gồm 2 nguyên tố Fe và O
Ta có sơ đồ: Fe: x mol; Fe(NO3)3: x mol; O : y mol
Ta có 56x + 16y = 11,36 (1)
Quá trình nhường electron:
Fe0 - 3e → Fe+3
x 3x
Quá trình nhận electron:
O+0 + 2e → O-2
y 2y
N+5 + 3e → N+2
0,18 0,06
Áp dụng định luật bảo toàn electron, ta có: 3x = 2y + 0,18 (2)
Từ (1) và (2) → x = 0,16 mol và y = 0,15 mol
⇒ mFe(NO3)3 = 0,16. 242 = 38,72 (g)
Ví dụ 9. Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Tính m ?
A. 42,18g
B. 38,72g
C. 36,27g
D. 41,24g
Đáp án hướng dẫn giải chi tiết
Số mol NO = 0,06 mol.
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Gọi số mol Fe và O tương ứng trong X là x và y ta có:
56x + 16y = 11,36 (1).
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
N+5 + 3e → N+2
Áp dụng định luật bảo toàn electron ta có: 3x = 2y + 0,18 (2)
Từ (1) và (2) => x = 0,16 và y = 0,15
=> m = 38,72 gam.
Ví dụ 10. Hoà tan hết m gam hỗn hợp X gồm Fe, Fe2O3, Fe3O4 trong dung dịch HNO3 đặc nóng thu được 4,48 lít khí màu nâu duy nhất (đktc). Cô cạn dung dịch sau phản ứng thu được 145,2 gam muối khan, giá trị m là:
A. 78,4
B. 139,2
C. 46,4
D. 46,256
Đáp án hướng dẫn giải chi tiết
Cách 1: Quy hỗn hợp X về hỗn hợp 2 chất FeO và Fe2O3 ta có:
Bảo toàn e: nFeO = nNO2 = 0,2 mol
Bảo toàn Fe: nFeO + 2.nFe2O3 = nFe(NO3)3 = 0,6 mol
=> nFe2O3 = 0,2 mol
=> mX = 0,2.72 + 0,2.160 = 46,4 gam
uy hỗn hợp X về 2 chất Fe và Fe2O3:
Hoà tan hỗn hợp X vào dung dịch HNO3 đặc nóng dư.
Bảo toàn e: 3.nFe = nNO2 => nFe = 0,2 / 3
nmuoikhan=nFe(NO3)3=145,2/242 = 0,6mol
Bảo toàn Fe : nFe + 2.nFe2O3 = nFe(NO3)3 => 0,2 / 3 + 2.nFe2O3 = 0,6
=> nFe2O3 = 0,8/3
=> mh2X=mFe + nFe2O3 = 0,23.56 + 0,83.160 = 46,4 gam
6. Bài tập vận dụng Fe tác dụng HNO3
Câu hỏi trắc nghiệm
Câu 1. HNO3 tác dụng được với tất cả các chất trong dãy nào sau đây:
A. NaHCO3, CO2, FeS, Fe2O3
B. K2SO3, K2O, Cu, Fe(NO3)3
C. FeO, Fe2(SO4)3, FeCO3, Na2O
D. CuSO4, CuO, Mg3(PO4)2.
Câu 2. Axit nitric đặc nguội có thể phản ứng được với các chất nào sau đây?
A. Al, CuO, Na2CO3
B. CuO, Ag, Al(OH)3
C. P, Fe, FeO
D. C, Ag, BaCl2
Câu 3. Hoà tan hoàn toàn 0,9 g kim loại X vào dung dịch HNO3 thu được 0,28 lít khí N2O (đktc). Vậy X có thể là:
| A. Cu | B. Fe | C. Zn | D. Al |
Câu 4. Cho các chất FeO, Fe2O3, Fe(NO3)2, CuO, FeS. Số chất tác dụng được với HNO3 giải phóng khí NO là:
| A. 3 | B. 4 | C. 5 | D. 6 |
Câu 5. Dung dịch nào sau đây không hòa tan được Cu kim loại:
A. Dung dịch HNO3
B. Dung dịch hỗn hợp NaNO3 + HCl
C. Dung dịch FeCl3
D. Dung dịch FeCl2
Câu 6. Để điều chế HNO3 trong phòng thí nghiệm, hóa chất nào sau đây được chọn làm nguyên liệu chính:
A. NaNO3, H2SO4 đặc
B. N2 và H2
C. NaNO3, N2, H2 và HCl
D. AgNO3 và HCl
Câu 7. Cho Fe(III) oxit tác dụng với axit nitric thì sản phẩm thu được là:
A. Fe(NO3)2, NO và H2O
B. Fe(NO3)2, NO2 và H2O
C. Fe(NO3)2, N2
D. Fe(NO3)3 và H2O
Câu 8. Hoà tan m gam Fe vào dung dịch HNO3 loãng, dư thu được 0,448 lit khí NO duy nhất (đktc). Giá trị của m là:
| A. 1,12 gam. | B. 11,2 gam. | C. 0,56 gam. | D. 5,6 gam. |
Câu 9. Cho HNO3 đậm đặc vào than nung đỏ có khí bay ra là:
A. CO2
B. NO2
C. Hỗn hợp CO2 và NO2
D. Không có khí bay ra
Câu 10. Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hóa - khử là:
| A. 8. | B. 5. | C. 7. | D. 6. |
Đáp án câu hỏi trắc nghiệm kim loại tác dụng axit nitrat
| 1C | 2C | 3D | 4C | 5D |
| 6A | 7D | 8A | 9C | 10C |
7. Câu hỏi bài tập tự luận kim loại tác dụng axit nitric
Câu 1. Hoà tan hoàn toàn m g bột Cu trong 800 g dung dịch HNO3 được dung dịch Y và 4,48 lit khí NO (đktc). Tính m?
Đáp án hướng dẫn giải chi tiết
Ta có: nNO = 4,48/22,4 = 0,2 mol
|
Quá trình cho e: Cu → Cu2+ + 2e 0,3 mol 0,3 mol 0,6 mol |
Quá trình nhận e: N5+ + 3e → N2+ 0,6 mol 0,6 mol 0,2 mol |
Áp dụng định luật bảo toàn electron: nCu = 0,3 mol; mCu = 0,3.64 = 19,2 gam.
Câu 2. Cho 11 g hỗn hợp hai kim loại Al và Fe vào dung dịch HNO3 loãng dư, thu được 6,72 lit khí NO (đktc) duy nhất. Khối lượng (g) của Al và Fe trong hỗn hợp đầu?
Đáp án hướng dẫn giải chi tiết
nNO = 6,72/22,4 = 0,3 mol
N+5 + 3e → N+2
Gọi x, y lần lượt là số mol Al và Fe trong hỗn hợp đầu
Ta có: 27x + 56y = 11 (1)
Al → Al+3 + 3e
x mol 3x mol
Fe → Fe+3 + 3e
y mol 3y mol
Theo định luật bảo toàn e: ne (KL nhường) = ne (N nhận) = 0,9 mol
hay: 3x + 3y = 0,9 (2)
Từ (1) và (2) ta có x = 0,2; y = 0,1 => mAl = 5,4; mFe = 5,6 gam
Câu 3. Cho 6 g hợp kim Mg và Al vào dung dịch HNO3 đặc, nguội lấy dư thấy có 4,48 lít khí NO2 bay ra (đktc). Thành phần % về khối lượng của hợp kim là?
Đáp án hướng dẫn giải chi tiết
Trong hỗn hợp chỉ có Mg phản ứng với dung dịch HNO3 đặc, nguội .
Mg → Mg2+ + 2e
x 2x
N5+ + 3e → N+4O2
0,2 0,2
n = 4,48/22,4 = 0,2 mol => ne nhận = n = 0,2 mol
Bảo toàn e
ne cho = ne nhận => nMg = 0,1 mol => mMg = 24.0,1 = 2,4 g
%mMg = 40%
=> %mAl = 100% - 40% = 60%
Bài 4. Cho m(g) Al tan hoàn toàn trong dung dịch HNO3 thấy tạo ra 11,2 lít (đktc) hỗn hợp 3 khí NO, N2O, N2 với tỉ lệ mol tương ứng là 1:2:1. Tìm m
Đáp án hướng dẫn giải chi tiết
Ta có n hỗn hợp khí =0,5 mol
→ nNO =nN2 =0,125 mol; nN2O= 0,25 mol.
Bảo toàn e:
3nAl = 3nNO +8nN2O +10nN2 = 3.0,125 + 8.0,25 + 10.0,125 = 3,625 mol → nAl = 29/24
→ m = 32,625 gam.
Bài 5. Cho m gam Mg tan hoàn toàn trong dung dịch HNO3, phản ứng làm giải phóng ra khí N2O (sản phẩm khử duy nhất) và dung dịch sau phản ứng tăng 3,9 gam. Tính m?
Đáp án hướng dẫn giải chi tiết
Mg(0) → Mg(+2) + 2e
4x------------------------8x
2N(+5) + 8e → N(+1)
8x---------x
Khi cho Mg vào dung dịch HNO3 thì có khí thoát ra, thấy khối lượng dung dịch tăng 3,9 gam nghĩa là m(Mg) – m(N2O) = 3,9
Hay: 4x. 24 – x. 44 = 3,9 nên x = 0,075 mol
Vậy m(Mg) = 4. 0,075. 24 = 7,2 (g)
Bài 6. Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc). Tính khối lượng Fe có trong hỗn hợp.
Đáp án hướng dẫn giải chi tiết
nNO = 1,344/22,4 = 0,06 mol
Coi hỗn hợp gồm Fe (x mol), O (y mol)
=> 56x + 16y = 11,36 (1)
Fe0 → Fe+3 + 3e
x → x → 3x
O0 + 2e → O-2
y → 2y
N+5 + 3e → N+2
0,18 ← 0,06
Bảo toàn e => 3x = 2y + 0,18 (2)
(1),(2) => x = 0,16; y = 0,15
=> nFe(NO3)3 = nFe = 0,16 mol
=> m = 0,16.242 = 38,72 gam
Bài 7. Để m gam bột Fe ngoài không khí một thời gian thu được 23,6 g hỗn hợp gồm Fe và các oxit sắt. Hòa tan hoàn toàn hỗn hợp đó bằng dung dịch HNO3 loãng thu được 4,48 lít khí NO duy nhất (đktc). Giá trị của m là:
Đáp án hướng dẫn giải chi tiết
Ta có: nNO = 0,2 mol
Áp dụng bảo toàn khối lượng: mO2 = mhỗn hợp - mFe = 23,6 - m (gam)
→ nO2 = (11,8-m)/32 mol
Ta có sơ đồ phản ứng:
Quá trình cho - nhận electron:
Quá trình khử Quá trình oxi hóa
Feo → Fe+3+ 3e O2 + 4e → 2O2-
N+5 + 3e → N+2
Áp dụng định luật bảo toàn electron: 3nFe = 4.nO2 + 3.nNO
3m/56 = 4.(23,6 − m)/ 32 + 3.0,1 → m = 19,88 (gam)
Bài 8. Cho 39,2 gam hỗn hợp M gồm Fe, FeO, Fe3O4, Fe2O3, CuO và Cu (trong đó oxi chiếm 18,367% về khối lượng) tác dụng vừa đủ với 850 ml dung dịch HNO3 nồng độ a mol/l. Sau khi phản ứng xong, thu được 0,2 mol NO (sản phẩm khử duy nhất của N+5). Giá trị của a là
Đáp án hướng dẫn giải chi tiết
Qui đổi hỗn hợp về: x mol Fe ; y mol Cu ; O
có : %mO = 18,367%mM => nO = 0,45 mol
Khi cho M + HNO3 → NO
Bảo toàn e : 3nFe + 2nCu = 2nO + 3nNO
=> 3x + 2y = 1,5 mol
Và : 56x + 64y = 32 g
=> x = 0,4 ; y = 0,15 mol
Bảo toàn N :
nHNO3 = 3nFe(NO3)3 + 2nCu(NO3)2 + nNO = 1,7 mol
=> a = 2M
Bài 9. Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất) (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
Đáp án hướng dẫn giải chi tiết
Xem hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 chỉ gồm 2 nguyên tố Fe và O
Ta có sơ đồ: Fe: x mol; Fe(NO3)3: x mol
O : y mol
Ta có 56x + 16y = 11,36 (1)
Quá trình nhường electron:
Fe0 - 3e → Fe+3
x → 3x
Quá trình nhận electron:
O + 2e → O-2
y → 2y
N+5 + 3e → N+2
0,18 → 0,06
Áp dụng định luật bảo toàn electron, ta có: 3x = 2y + 0,18 (2)
Từ (1) và (2) → x = 0,16 mol và y = 0,15 mol
⇒ mFe(NO3)3 = 0,16. 242 = 38,72 (g)
............................................
Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư), sinh ra V lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra? được VnDoc biên soạn trong bộ bài tập Nitric nhằm củng cố bài tập trên lớp cho các bạn nắm vững lí thuyết trên lớp
Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 11


