Đáp án đề thi tuyển sinh 10 chuyên Hóa Sở GD&ĐT Hà Nội 2020
Sáng 19/07/2020, Sở GD&ĐT Thành phố Hà Nội chính thức tổ chức kì thi chung tuyển sinh vào lớp 10 Chuyên năm 2020 môn Vật Lý, Hóa học, Sử, Địa Lý và Sinh học. Đề thi Hóa học vào 10 Hà Nội diễn ra trong thời gian 120 phút. Đề thi & Đáp án sẽ được VnDoc.com đăng tải mời các bạn tham khảo
Đáp án đề thi tuyển sinh lớp 10 môn Hóa chuyên Hà Nội
Các em học sinh gửi đề thi cho Fanpage VnDoc.com tại: VnDoc.com để có đáp án NHANH và CHÍNH XÁC nhất.
- Đáp án đề thi tuyển sinh lớp 10 môn Toán Hà Nội năm 2020
- Đáp án Đề thi tuyển sinh lớp 10 môn Anh Hà Nội năm 2020
- Đáp án đề thi tuyển sinh lớp 10 môn Văn Hà Nội năm 2020
1. Đáp án Đề thi tuyển sinh lớp 10 chuyên Hóa Hà Nội năm 2020
Câu I.
1.
Vì trong không khí có 1 lượng CO2, Ca(OH)2 để ngoài trời sẽ phản ứng với CO2 taọ thành kết tủa trắng CaCO3
CO2 + Ca(OH)2 → CaCO3 + H2O
Lượng CO2 trong không khí ít, lượng CaCO3 được tạo thành từ từ, lâu ngày tạo thành mảng váng trắng bám trên bề mặt,
2.
a) Hiện tượng: Mẩu than gỗ cháy làm mồi cho day sắt cháy. Khi đưa vào bình đựng sẵn khí oxi thì dây sắt cháy sáng chói trong bình, không tạo lửa, tạo ra hạt nhỏ cháy màu nâu đỏ sắt Fe3O4
3Fe + 2O2 ![]() \(\overset{t^{o} }{\rightarrow}\) Fe3O4
\(\overset{t^{o} }{\rightarrow}\) Fe3O4
b) Nhỏ vài giọt AgNO3 và dung dịch NaCl thấy xuất hiện kết tủa trắng là AgCl do có phản ứng: AgNO3 + NaCl→ AgCl↓ + NaNO3
Sau đó lọc kết tủa AgCl đưa ra ngoài ánh sáng thì ta thấy xuất hiện chất rắn trắng màu xám là bạc, do AgCl dễ bị phân hủy khi có ánh sáng.
PTHH: 2AgCl(rắn)![]() \(\overset{t^{o} }{\rightarrow}\) 2Ag(rắn) + Cl2 (khí)
\(\overset{t^{o} }{\rightarrow}\) 2Ag(rắn) + Cl2 (khí)
(trắng) (trắng xám)
c) Cho mẩu natri vào ống thí nghiệm đựng nước. Đậy ống nghiệm bằng nút cao su có vuốt dẫn khí bằng thủy tinh xuyên qua. Sau một gian, đốt khí thoát ra từ vuốt dẫn khí
Hiện tượng: Cho mẩu natri vào ống nghiệm đựng nước ⇒ Natri chạy tròn trên bề mặt ống nghiệm, natri tan dần tạo ra khí không màu thoát ra bên ngoài, phản ứng tỏa nhiều nhiệt. Đốt khí thoát ra ta thấy khí cháy cho ngọn lửa màu xanh nhạt, xuất hiện những giọt nước tạo thành.
PTHH:
2Na + 2H2O → 2NaOH + H2↑
2H2 + O2 ![]() \(\overset{t^{o} }{\rightarrow}\) H2O
\(\overset{t^{o} }{\rightarrow}\) H2O
Câu II.
1.
2C2H5OH + 2Na → 2C2H5ONa + H2
CH3COOH + Na2CO3 → CH3COONa + CO2 + H2O
Fe3O4 + 4CO ![]() \(\overset{t^{o} }{\rightarrow}\) 3Fe + 4CO2
\(\overset{t^{o} }{\rightarrow}\) 3Fe + 4CO2
4HCl + MnO2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Cl2 + MnCl2 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) Cl2 + MnCl2 + 2H2O
2.
Sử dụng quỳ tím nhận biết được 2 nhóm: nhóm 1: HCl, H2SO4 quỳ chuyển sang đỏ
Nhóm 2: Không đổi màu quỳ là Na2SO4 và NaNO3
Cho dung dịch BaCl2 vào 2 nhóm trên:
Nhóm 1: ống nghiệm xuất hiện kết tủa trắng BaSO4 là axit H2SO4, không hiện tượng gì là HCl
Nhóm 2: ống nghiệm xuất hiện kết tủa trắng BaSO4 là muối Na2SO4, không hiện tượng gì là NaNO3
PTHH: BaCl2 + H2SO4 → BaSO4 + HCl
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
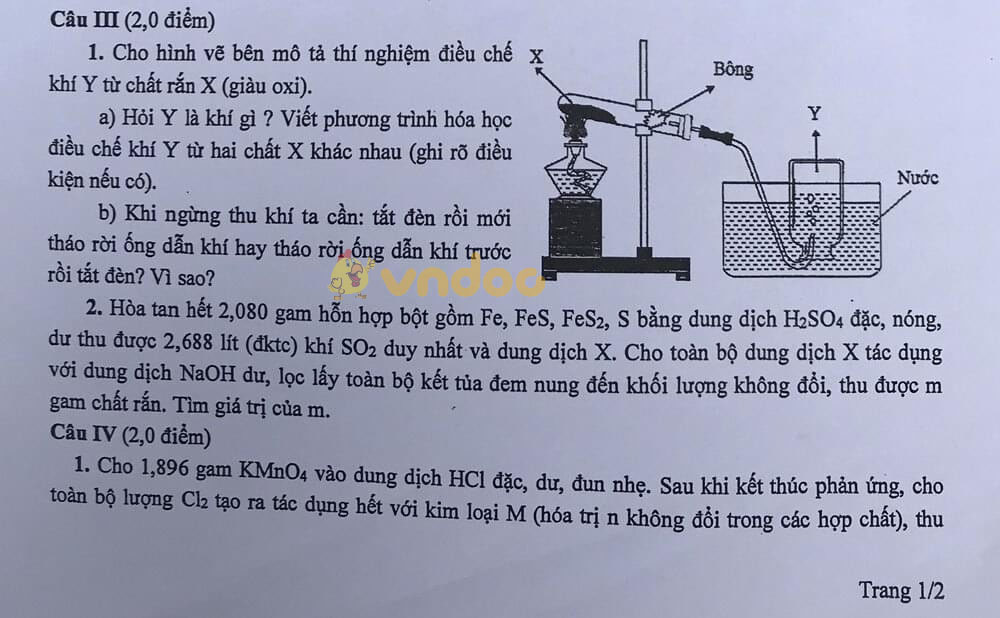
Câu III.
1.
a) Y là khí O2
2KMnO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
\(\overset{t^{\circ } }{\rightarrow}\) K2MnO4 + MnO2 + O2
2KClO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 3O2
b) Khi ngừng thu khí oxi ta phải tháo rời ống dẫn khí trước khi tắt đèn cồn vì: Nếu tắt đèn cồn trước sẽ có sự chênh lệch nhiệt độ, áp suất giảm đột ngột làm cho nước bị hút ngược trở lại, ống nghiệm đang nóng gặp lạnh sẽ vỡ
2.
Quy đổi hỗn hợp Fe, FeS, FeS2, S thành Fe ( x mol), S ( y mol)
nSO2 = 0,12 mol
Quá trình trao đổi electron
Feo → Fe+3 + 3e S+6 + 2e → S+4
x → 3x 0,24 0,12
So → S+6 + 6e
y → 6y
Áp dụng BTE: 3x + 6y = 0,24 (1)
Theo đề bài: 56x + 32y = 2,080 (2)
Giải hệ phương trình: x = 0,02, y = 0,03
Dung dịch X: Fe2(SO4)3 = 0,01 mol
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3Na2SO4
0,01 → 0,02 mol
2Fe(OH)3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Fe2O3 + 3H2O
\(\overset{t^{\circ } }{\rightarrow}\) Fe2O3 + 3H2O
0,02 → 0,01 => mrắn = 0,01 .160 = 1,6 gam
Câu IV.
1.
nKMnO4 = 0,012 mol
2KMnO4 + 16HCl ![]() \(\overset{t^{o} }{\rightarrow}\) 2KCl + 2MnCl2 + 8H2O + 5Cl2
\(\overset{t^{o} }{\rightarrow}\) 2KCl + 2MnCl2 + 8H2O + 5Cl2
0,012 → 0,03
BT Cl => nAgCl = 2nCl2 = 0,06 mol
=> mAgCl = 0,06.143,5 = 8,61 gam < 12,93 gam
=> Ngoài kết tủa AgCl thì còn có kết tủa khác
Kim loại M có phản ứng với AgNO3
Khi cho Cl2 tác dụng hết với kim loại M (có hóa trị không đổi)
nCl2 + 2M ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2MCln
\(\overset{t^{\circ } }{\rightarrow}\) 2MCln
0,06 → 0,06/n
Hỗn hợp chất rắn X gồm MCln (0,06/n) và M dư (a mol)
mX = 0,06/n.(M + 35,5n) + a.M (1)
Khi cho X tác dụng với AgNO3 dư:
MCln + nAgNO3 → nAgCl + M(NO3)n
0,06/n → 0,06
M + nAgNO3 → nAg + M(NO3)n
a na
=> mkết tủa = 0,06 .143,5 + 108.an = 12,93 => an = 0,04 mol
=> a = 0,04/n thay vào (1)
0,06/n.(M+35,5.n) + (0,04/n).M = 5,38
=> 0,06M + 2,13n + 0,04M = 5,38n
=> M = 32,5n
Biện luận với các giá trị n lần lượt: 1,2,3 với n = 2 ta được M = 65 => Kim loại M là Zn
2.
Goi số mol FeO, Cu, Fe2O3 lần lượt là x, y, z
Khi cho X tác dụng với HCl vừa đủ thu được dung dịch Y gồm 2 chất tan => Y chứa FeCl2 và CuCl2
FeO + 2HCl → FeCl2 + H2O
x → x
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
z → 2z
2FeCl3 + Cu → 2FeCl2 + CuCl2
2z → z →2z →z
Cu phản ứng vừa đủ với FeCl3 => z = y (1)
Dung dịch Y chứa FeCl2 (x + 2z mol) và CuCl2 (z mol)
Khi cho dung dịch Y tác dụng với AgNO3 dư:
FeCl2 + 3AgNO3 → 2AgCl + Ag + Fe(NO3)3
(x + 2z) → 2(x+2z) → (x+2z)
CuCl2 + 2AgNO3 → 2AgCl + Cu(NO3)2
z → 2z
=> mkết tủa AgCl, Ag = 143,5 .(2x + 6z) + 108.(x+2z) = 36,8 (2)
BTNT Fe => nFe2O3 = 1/2nFeO + nFe2O3 = 0,5.x + z mol
BTNT Cu => nCuO = nCu = y (mol)
=> mchất rắn = 160.(0,5.x + z) + 80y = 8 (3)
Giải hệ phương trình được: x = 0,025 mol, y = 0,025 mol; z = 0,025 mol
=> m = 0,025.72 + 0,025.160 + 0,025.64 = 7,4 gam
Mặt khác cho X phản ứng với H2SO4 đặc:
Quá trình trao đổi e:
Fe2+ → Fe3+ + 1e S+6 + 2e → S+4
Cuo → Cu2+ + 2e
Áp dụng BTE: nFeO + 2nCu = 2nSO2 => nSO2 = 0,0375 mol
=> V = 0,84 lít
Câu V.
Y làm quỳ tím chuyển sang màu đỏ => Y là axit => CTCT Y: CH3COOH: axit axetic
CTCT X: CH3CH2OH: rượu etylic (hoặc ancol etylic)
CTCT Z: CH3COOCH2CH3: etyl axetat
PTHH:
CH3COOH + CH3CH2OH ![]() \(\overset{H^{+},xt }{\rightarrow}\) CH3COOCH2CH3 + H2O
\(\overset{H^{+},xt }{\rightarrow}\) CH3COOCH2CH3 + H2O
2.
Ta có:
nX = 0,135 mol
nH2O = 0,27 mol
Số nguyên tử H trung bình = 2nH2O/nX = 2.0,27/0,135 = 4
Gọi công thức tổng quát của hỗn hợp là CnH4
=> Độ bão hòa trung bình được tính: k = (2C + 2 - H)/2 = (2n+2-4)/2 = n - 1
CnH4 + (n-1)Br2 →
0,04/(n-1)←0,04
=> mX = 0,04/(n-1). (12n + 4) = 1,92 => n = 13/9
C13/9H4 + 22/9O2 → 13/9CO2 + 2H2O
0,135 → 0,33 → 0,195
=> m = 0,195.44 = 8,58 gam
V = 7,392 lít
2. Đề thi tuyển sinh lớp 10 chuyên Hóa Hà Nội năm 2020


.............................
Mời bạn đọc tham khảo thêm nhiều tài liệu ôn thi vào lớp 10 năm 2020 các môn khác nhau như: ôn thi vào lớp 10 môn Toán, ôn thi vào lớp 10 môn Văn, ôn thi vào lớp 10 môn Tiếng Anh ... được cập nhật liên tục trên VnDoc.com.



