Đề thi học kì 1 Hóa 11 Chân trời sáng tạo - Đề 5
Đề thi học kì 1 Hóa 11 CTST
Lớp:
Lớp 11
Môn:
Hóa Học
Dạng tài liệu:
Đề thi
Bộ sách:
Chân trời sáng tạo
Loại:
Tài liệu Lẻ
Loại File:
Word + PDF
Phân loại:
Tài liệu Tính phí

ĐỀ 5
ĐỀ THI CUỐI HỌC KỲ I
NĂM HỌC ……
MÔN: HÓA 11
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí
sinh chỉ chọn một phương án.
Câu 1.NB. Phản ứng nào sau đây là phản ứng thuận nghịch?
A. Mg + 2HCl ⟶ MgCl
2
+ H
2
. B. 2SO
2
+ O
2
⇌ 2SO
3
.
C. C
2
H
5
OH + 3O
2
o
t
2CO
2
+ 3H
2
O. D. 2KClO
3
o
t
2KCl + 3O
2
Câu 2.NB. Yếu tố nào sau đây không làm dịch chuyển cân bằng của hệ phản ứng?
A. Nhiệt độ. B. Áp suất. C. Nồng độ. D. Chất xúc tác.
Câu 3.NB. Khi một hệ ở trạng thái cân bằng thì trạng thái đó là cân bằng
A. tĩnh. B. động. C. bền. D. không bền.
Câu 4.NB. Phương trình điện li nào dưới đây viết không đúng?
A.
HCl H Cl .
B. CH
3
COOH ⇌ CH
3
COO
-
+ H
+
C. KOH ⇌ K
+
+ OH
-
D.
3
3 4 4
Na PO 3Na PO .
Câu 5.NB. Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
A. CaCl
2
.
B. HNO
3
. C. NaOH. D. C
12
H
22
O
11
.
Câu 6.NB. Trong phương pháp chuẩn độ acid-base, thời điểm hai chất tác dụng vừa đủ với nhau hoàn toàn
gọi là điểm
A. nóng. B. tương đương. C. tọa độ. D. cân bằng.
Câu 7.NB. Cho phương trình: CH
3
COOH + H
2
O
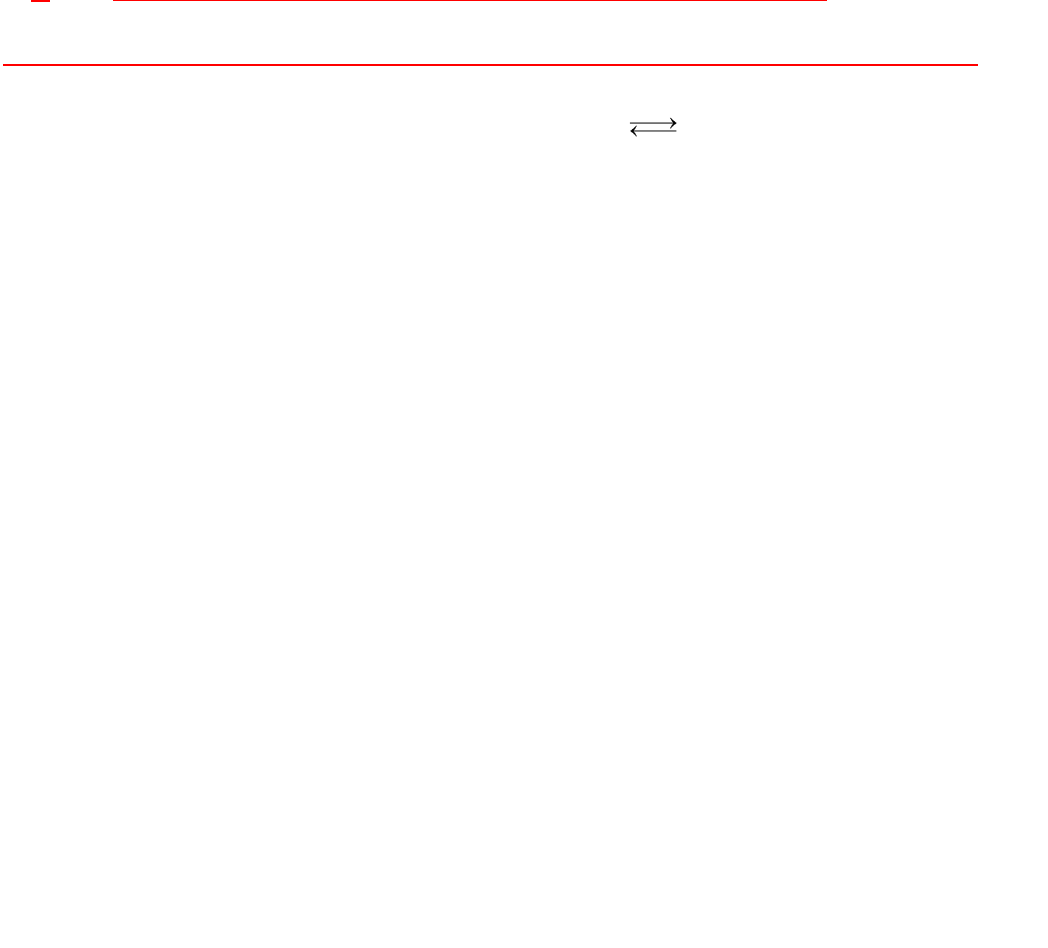
ˆ ˆ †
‡ ˆ ˆ
CH
3
COO
-
+ H
3
O
+
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là acid?
A. CH
3
COOH. B. H
2
O. C. CH
3
COO
-
. D. H
3
O
+
.
Câu 8.TH. Cho cân bằng (trong bình kín) sau: CO (g) + H
2
O (g) ⇌ CO
2
(g) + H
2
(g)
o
r 298
H
< 0
Trong các yếu tố: (1) tăng nhiệt độ; (2) thêm một lượng hơi nước; (3) thêm một lượng H
2
; (4) tăng áp suất
chung của hệ; (5) dùng chất xúc tác. Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là
A. (1), (4), (5). B. (1), (2), (3). C. (2), (3), (4). D. (1), (2), (4).
Câu 9. VD. Cho các cân bằng sau:
(1) H
2
(g) + I
2
(g) 2HI(g)(4) 2HI(g) H
2
(g) + I
2
(g)
(2)
1
2
H
2
(g) +
1
2
I
2
(g) HI(g) (5) H
2
(g) + I
2
(s) 2HI(g)
(3) HI(g)
1
2
H
2
(g) +
1
2
I
2
(g)
Ở nhiệt độ xác định, nếu K
C
của cân bằng (1) bằng 64 thì K
C
bằng 0,125 là của cân bằng
A. (5). B. (2). C. (3). D. (4).
Câu 10.VD. Có 4 dung dịch: Sodium chloride (NaCl), ancol ethylic (C
2
H
5
OH), acetic acid (CH
3
COOH),
potassium sulfate ( K
2
SO
4
) đều có nồng độ 0,1 mol/L. Khả năng dẫn điện của các dung dịch đó tăng dần
theo thứ tự nào trong các thứ tự sau:
A. NaCl < C
2
H
5
OH < CH
3
COOH < K
2
SO
4
. B. C
2
H
5
OH < CH
3
COOH < NaCl < K
2
SO
4
.
C. C
2
H
5
OH < CH
3
COOH < K
2
SO
4
< NaCl. D. CH
3
COOH < NaCl < C
2
H
5
OH < K
2
SO
4
.
Câu 11.NB. Trong khí quyển, nguyên tố nitrogen tồn tại chủ yếu dưới dạng chất nào sau đây?
A. NO
2
. B. N
2
. C. NO. D. NH
3
.
Câu 12.NB. Cho vài giọt quỳ tím vào dung dịch NH
3
thì dung dịch chuyển thành
A. màu hồng. B. màu vàng. C. màu đỏ. D. màu xanh.
Câu 13. NB. Cho Fe tác dụng với dung dịch HNO
3
đặc, nóng thu được khí X có màu nâu đỏ. Khí X là?
A. N
2
. B. N
2
O
. C. N
O
. D. N
O
2
.
Câu 14.NB. SO
2
là một khí độc được thải ra từ các vùng công nghiệp, là một trong những nguyên nhân
chính gây ra hiện tượng nào dưới đây?
A. Mưa acid. B. Hiệu ứng nhà kính.
C. Hiệu ứng đomino. D. Sương mù.
Câu 15. NB. Tính chất nào sau đây không phải tính chất của dung dịch sulfuric acid đặc?
A. Tính háo nước. B. Tính oxi hóa. C. Tính acid. D. Tính khử.
Câu 16. NB.Hiện tượng phú dưỡng là một biểu hiện của môi trường ao, hồ bị ô nhiễm do dư thừa các chất
dinh dưỡng. Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nào sau đây vượt quá mức cho phép?
A. Na
+
, K
+
. B. Ca
2+
, Mg
2+
. C. NO
3
-
, PO
4
3-
.
D. Cl
-
, SO
4
2-
.
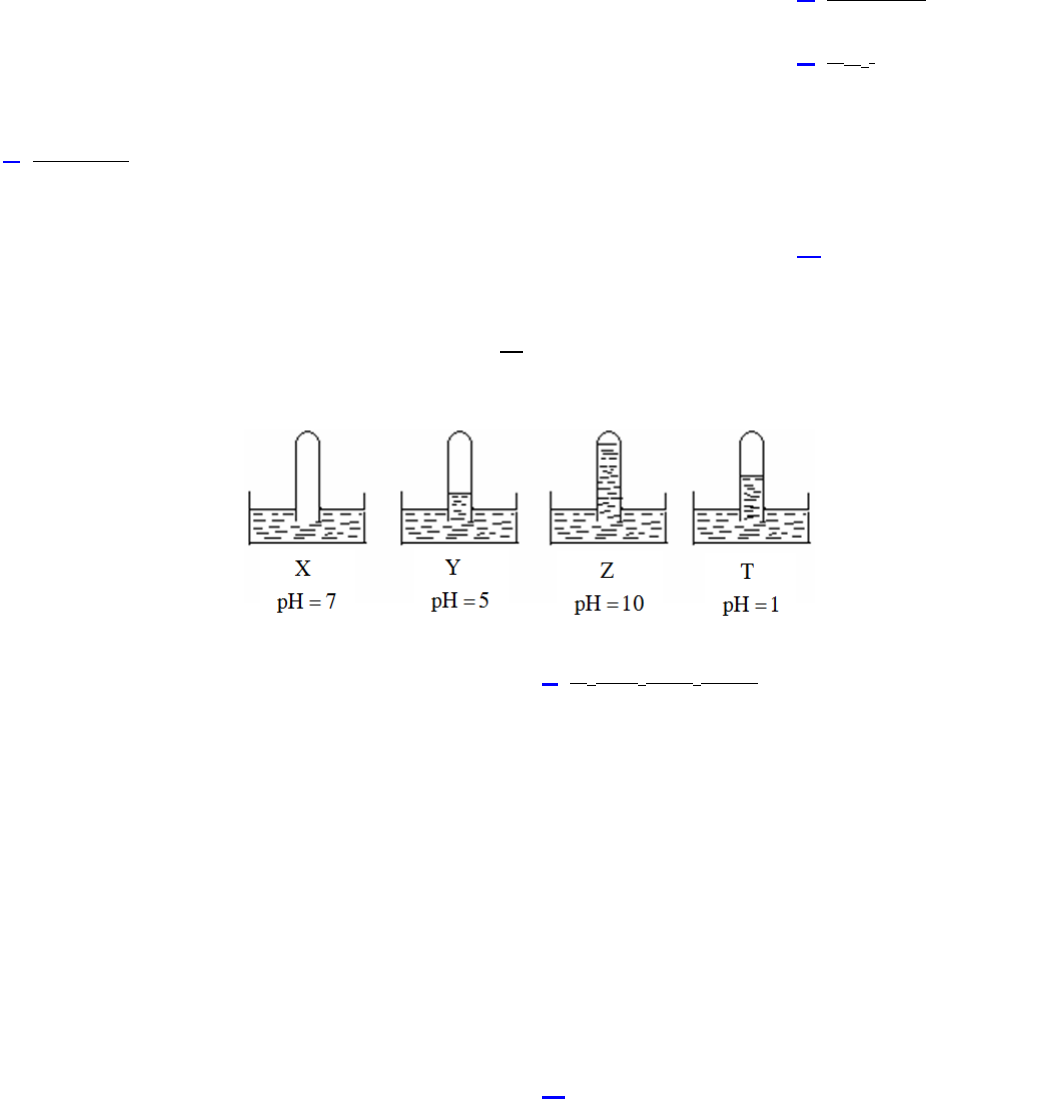
Câu 17.VD. Có 4 ống nghiệm, mỗi ống đựng một chất khí khác nhau, chúng được úp ngược trong các chậu
nước X, Y, Z, T. Kết quả thí nghiệm được mô tả bằng hình vẽ sau:
Các khí X, Y, Z, T lần lượt là:
A. NH
3
, HCl, O
2
, SO
2
. B. O
2
, SO
2
, NH
3
, HCl.
C. SO
2
, O
2
, NH
3
, HCl. D. O
2
, HCl, NH
3
, SO
2
.
Câu 18.VD. Có các thí nghiệm sau:
(1) Khí SO
2
làm mất màu nước bromine.
(2) Cho dung dịch BaCl
2
tác dụng với dung dịch H
2
SO
4
thu được kết tủa màu trắng.
(3) Nhôm (aluminium) tan trong dung dịch H
2
SO
4
đặc, nguội.
(4) Sulfur là chất rắn, màu trắng, không tan trong nước.
(5) Sulfur và sulfur dioxide vừa có tính oxi hóa, vừa có tính khử.
(6) Khi phản ứng với hydrogen, sulfur thể hiện tính oxi hóa
(7) Nước thải sinh hoạt là một trong các nguồn phát thải khí SO
2
.
(8) Sulfur dioxide được sử dụng để tẩy trắng vải sợi, bột giấy, sản xuất sulfuric acid và diệt nấm mốc.
Số thí nghiệm xảy ra phản ứng hoá học là
A. 3. B. 6. C. 5. D. 4.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu,
thí sinh chọn đúng hoặc sai.(Đ – S)
Câu 1: Độ acid và độ kiềm của dung dịch có thể được đánh giá bằng nồng độ H
+
(Nồng độ H
+
càng cao thì
pH càng nhỏ) hoặc quy về một giá trị gọi là pH (pH là chỉ số đánh giá độ acid hay base của một dung dịch)
a.TH. Để so sánh mức độ acid giữa các dung dịch có thể dựa vào nồng độ: dung dịch acid nào có nồng độ
mol lớn hơn sẽ có tính acid mạnh hơn.
b.TH. Cho các dung dịch có cùng nồng độ: K
2
SO
3
(1), NaClO
4
(2), HNO
3
(3) Ca(OH)
2
(4). Chất có giá trị
pH cao nhất là (1).
c.TH. Cho ba dung dịch có cùng giá trị pH: NH
3
(1) , Ca(OH)
2
(2) , KOH (3). Nồng độ mol các dung dịch
được sắp xếp theo thứ tự giảm dần theo thứ tự là : (2),(3),(1).
d. NB. Trong các dung dịch có cùng nồng độ, dung dịch có nồng độ ion H
+
nhỏ hơn và pH cao sẽ có tính
acid yếu hơn.
Câu 2. Cho sơ đồ chuyển hoá sau:
NH
3
0
2
(xt: Pt, t ) O
X
2
O
Y
22
HO O
Z
NaOH
T
0
t
P.
Biết X, Y, Z, T, P là các hợp chất chứa nitrogen.
a. TH. NH
3
thể hiện tính khử.
b.VD. X và T lần lượt N
2
O và NaNO
3
.
c. VD. X và T lần lượt là NO
2
và HNO
3
.
d.VD. Z và P lần lượt là HNO
3
và NaNO
2
.
Câu 3. Sulfuric acid là hóa chất rất quan trọng trong nhiều lĩnh vực, có hoạt tính hóa học rất mạnh.
a. NB. Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay.
b. TH. Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid, không làm ngược lại gây nguy hiểm.
c. TH. Khi bị bỏng sulfuric acid đặc, điều đầu tiên cần làm là xả nhanh chỗ bỏng với nước lạnh.
d. TH.Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen.
Câu 4. Xét cân bằng trong bình kín có dung tích không đổi: X
(g)
2Y
(g)
. Ban đầu cho 1 mol khí X vào
bình, khi đạt đến trạng thái cân bằng thì thấy: Tại thời điểm ở 35
0
C trong bình có 0,730 mol X; Tại thời
điểm ở 45
0
C trong bình có 0,623 mol X.
a. VD. Phản ứng thuận là phản ứng thu nhiệt.
b. VD. Khi tăng áp suất, cân bằng chuyển dịch theo chiều nghịch.
c. VD. Thêm tiếp Y vào hỗn hợp cân bằng thì làm cho cân bằng chuyển dịch theo chiều nghịch.
d. NB. Thêm xúc tác thích hợp vào hỗn hợp cân bằng thì cân bằng vẫn không chuyển dịch.
PHẦN III: Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1.TH. Cho các chất: Al
2
(SO
4
)
3
, CH
3
COOH, CH
4
, AgCl, Fe(OH)
3
, C
6
H
12
O
6
, NH
3
, SO
3
, SiO
2
, KOH,
H
2
O, CaSO
3
, H
2
S, H
3
PO
4
.
Trong các chất trên, có a chất điện li trong đó gồm b chất điện li yếu và các chất điện limạnh. Tính giá trị a
+ b.
Câu 2. TH. Ammonia
3
(NH )
được điều chế bă
̀
ng phản ứng
2 2 3
N (g) 3H (g) 2NH (g)
ˆ ˆ †
‡ ˆ ˆ
Ơ
̉
t
o
C, nồng độ các chất ở trạng thái cân bă
̀
ng la
̀
2 2 3
N =0,45M, H =0,14M, NH =0,62M
.
Tính hằng số cân bă
̀
ng
C
K
của phản ứng trên tại t
o
C. (làm tròn đến số thập phân hàng chục)
Câu 3. VD. Một mẫu nước thải của nhà máy sản xuất có pH = 3. Để thải ra ngoài môi trường thì cần phải
tăng pH lên từ 5,8 đến 8,6 (theo đúng qui định), nhà máy phải dùng vôi sống thải vào nước thải. Để nâng pH
của 1,5 m
3
nước thải từ 3 lên 7 cần dùng m gam vôi sống . (Bỏ qua sự thủy phân của các muối nếu có).Tính
giá trị m.
Câu 4. TH. Cho phản ứng: Al+ HNO
3
→ Al(NO
3
)
3
+ N
2
O + H
2
O. Khi cân bằng hệ số của HNO
3
là bao
nhiêu?
Câu 5. TH. Cho 50 ml dung dịch KOH 1M vào 20 ml dung dịch (NH
4
)
2
SO
4
0,5M, đun nóng nhẹ thu được
V lít khí ở đkc. Tính giá trị của V.
Câu 6. VD. Sulfuric acid có thể được điều chế từ quặng pyrite theo sơ đồ:
oo
2 2 2
O ,t O ,t H O
2 2 3 2 4
(1) (2) (3)
FeS SO SO H SO
Đề kiểm tra học kì 1 lớp 11 môn Hóa học có đáp án
Đề thi học kì 1 Hóa 11 Chân trời sáng tạo - Đề 5 có đáp án là tài liệu hữu ích giúp bạn đọc có thể trau dồi, luyện tập nội dung kiến thức để chuẩn bị thật tốt cho kì thi cuối học kì 1 lớp 11 sắp tới nhé. Đề thi được tổng hợp gồm có 18 câu hỏi trắc nghiệm nhiều phương án lựa chọn, 4 câu hỏi trắc nghiệm đúng sai và 6 câu hỏi trắc nghiệm trả lời ngắn. Thí sinh làm bài trong thời gian 50 phút. Đề có đáp án và lời giải chi tiết kèm theo. Mời các bạn cùng theo dõi đề thi dưới đây.



