Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017
Đề thi học kì 1 môn Hóa học lớp 10
Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017 là đề kiểm tra học kì I lớp 10 dành cho các bạn học sinh tham khảo nhằm củng cố kiến thức. Đề thi môn Hóa có đáp án đi kèm, thuận tiện hơn khi luyện tập và kiểm tra kết quả. Chúc các bạn học tốt.
Đề thi học kì 1 môn Toán lớp 10 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017
Đề thi học kì 1 môn Vật lý lớp 10 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017
Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Đa Phúc, Hà Nội năm học 2015 - 2016
|
Trường THPT Đa Phúc |
ĐỀ KIỂM TRA HỌC KÌ I |
|
Năm học: 2016-2017 |
Môn: Hóa học - Lớp 10 |
|
---------š&›---------
|
Thời gian: 45 phút (Lưu ý: HS phải ghi mã đề thi vào bài làm) |
Mã đề 101
A- Trắc nghiệm: (3,0 điểm)
Câu 1. Các hạt cấu tạo nên hầu hết các nguyên tử là:
A. Proton và electron. B. Proton và nơtron. C. Proton, nơtron và electron. D. Nơtron và electron.
Câu 2. Nguyên tố X thuộc chu kỳ 3, nhóm IVA trong bảng tuần hoàn. Cấu hình electron nguyên tử của X là:
A. 1s22s22p63s23p4 B. 1s22s22p63s23p2 C. 1s22s22p63s23p63d104s24p2 D.1s22s22p63s23p6
Câu 3. Hợp chất X tạo ra oxit cao nhất có công thức là AO2.Trong hợp chất khí với hiđro A chiếm 75% về khối lượng. Nguyên tố A là:
A. C (M = 12) B. Si (M = 28) C. S (M = 32) D. Cl (M = 35,5)
Câu 4. Nguyên tử của các nguyên tố thuộc chu kì 5 có số lớp electron là:
A. 3 B. 4 C. 5 D. 6
Câu 5. Các nguyên tố 16X, 13Y, 9Z, 8T xếp theo thứ tự tính phi kim tăng dần là:
A. Y, X, Z, T B. Y, X, T, Z. C. Y, T, Z, X. D. X, T, Y, Z.
Câu 6. Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 21H trong 10 ml nước (biết trong nước chỉ có đồng vị 11H và 21H; khối lượng riêng của nước là 1 g/ml).
A. 5,35. 1020 B. 5,35. 1021 C. 5,35. 1022 D. 5,35. 1023
Câu 7. Chọn cấu hình electron đúng của ion Fe3+ (Z = 26)
A. 1s22s22p63s23p63d5 B. 1s22s22p63s23p63d6
C. 1s22s22p63s23p63d6 4s2 D. 1s22s22p63s23p63d34s2
Câu 8. Hòa tan hoàn toàn 0,3 gam hỗn hợp hai kim loại X và Y ở hai chu kì liên tiếp của nhóm IA vào nước thì thu được 0,224 lít khí hiđro ở đktc. Hai kim loại đó là (Biết Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133).
A. Li và Na. B. Na và K. C. K và Rb. D. Rb và Cs.
Câu 9. Trong tự nhiên Bo có 2 đồng vị là 11B (81%) và 10B (19%). Nguyên tử khối trung bình của Bo là:
A. 81 B. 19 C. 10,18 D. 10,81
Câu 10. Hợp chất A được tạo thành từ ion M+ và ion X2- (được tạo ra từ các nguyên tố M và X tương ứng). Trong phân tử A có tổng số các hạt cơ bản là 92, trong đó số hạt mang điện bằng 65,22% tổng số hạt. Số khối của M lớn hơn của X là 7. Nguyên tố M là:
A. Li B. Na C. K D. H
Câu 11. Chất nào sau đây chỉ chứa các liên kết cộng hóa trị?
A. CaCl2. B. Na2O C. KCl D. H2S
Câu 12. Cho dãy chất sau: NH3 , N2O , N2 , HNO3. Số oxi hóa của nitơ trong các chất lần lượt là:
A. -3, 0, +1, +5 B. +3, +1, 0, +6 C. -3, +1, 0, +5 D. -3, +1, +2, +5
B- Tự luận: (7,0 điểm)
Câu 1. (1,0 điểm)
Nguyên tử của một nguyên tố X có tổng số hạt cơ bản là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Tìm số p, e, n và số khối của nguyên tử nguyên tố X.
Câu 2. (3 điểm)
a/ Viết cấu hình e nguyên tử của các nguyên tố X, Y, T, Q trong các trường hợp sau: (1 điểm)
- X có Z = 20. - Nguyên tử Y có tổng số electron trên phân lớp p là 9.
- Q có Z = 29. - T có cấu hình electron ion T2-: 1s2 2s2 2p6.
b/ Xác định vị trí của nguyên tố X, Q trong bảng tuần hoàn. Giải thích. (1 điểm)
c/ Nêu tính chất hóa học cơ bản của nguyên tố X, Y. Giải thích. (1 điểm).
Câu 3. (3,0 điểm)
Hòa tan hoàn toàn 13,8 gam hỗn hợp A gồm hai kim loại Fe, Al vào 750 ml dung dịch HCl 1,6M (D = 1,1g/ml) thu được 10,08 lít khí (đktc) và dung dịch B.
a/ Tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp A. (1,5 điểm)
b/ Tính nồng độ phần trăm của các chất trong dung dịch B. (1 điểm)
c/ Nhỏ từ từ dung dịch KOH 15% vào dung dịch B đến khi thu được kết tủa có khối lượng không đổi, lọc lấy kết tủa đem nung ngoài không khí được m gam chất rắn. Tính khối lượng dung dịch KOH và m? (0,5 điểm)
(Cho M của các nguyên tố: Al = 27, Fe = 56, O = 16, H = 1, Cl = 35,5)
Đáp án đề thi học kì 1 môn Hóa học lớp 10
ĐÁP ÁN MÃ ĐỀ 101
I. Trắc nghiệm: (3,0 điểm) 12 câu x 0,25đ = 3đ
|
CÂU |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
ĐA |
C |
B |
A |
C |
B |
B |
A |
A |
D |
B |
D |
C |
II. Tự luận (7,0 điểm)
Câu 1 (1,0 điểm)

Câu 2 (3,0 điểm)
a) Cấu hình electron nguyên tử: 1 điểm
X (Z = 20): 1s22s22p6 3s23p64s2 Y: 1s2 2s2 2p6 3s2 3p3
Q (Z = 29): 1s2 2s2 2p6 3s2 3p6 3d10 4s1
b) Vị trí của X, Q trong bảng tuần hoàn: 1 điểm
X: - Ô: 20 (vì Z = 20)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IIA (vì là nguyên tố s và có 2 electron lớp ngoài cùng)
Q: - Ô: 29 (vì Z = 29)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IB (vì là nguyên tố d và có 1 electron hoá trị)
c) Tính chất: 1 điểm
* X - là kim loại vì có 2e lớp ngoài cùng.
- Hóa trị cao nhất với oxi là II, Hoá trị trong hợp chất khí với hiđro: không có vì là kim loại
- Công thức oxit cao nhất XO => là oxit bazo; CT hiđroxit tương ứng X(OH)2 => là bazo
* Y - là phi kim vì có 5e lớp ngoài cùng.
- Hóa trị cao nhất với oxi là V, Hoá trị trong hợp chất khí với hiđro là III
- Công thức oxit cao nhất X2O5 => là oxit axit; CT hiđroxit tương ứng H3XO4 => là axit
- CT hợp chất khí với hiđro là YH3.
Câu 3 (3,0 điểm)
a. Fe + 2 HCl → FeCl2 + H2↑ (1)
x 2x x x
2Al + 6HCl → 2AlCl3 + 3H2↑ (2)
y 3y y 3y/2
Đặt x, y lần lượt là số mol của Fe và Al
Hệ pt: 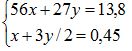
Giải hệ được: x = 0,15 mol; y = 0,2 mol
=> %Fe = 60,87% và %Al = 39,13%
b. Dd sau phản ứng gồm: FeCl2 0,15 mol; AlCl3 0,2 mol; HCl dư: 1,2 - (2x + 3y) = 0,3 mol
mddB = mA + mddHCl – mH2 = 13,8 + 750.1,1 – 0,45x2 = 837,9g
C%FeCl2 = 2,27%; C%AlCl3 = 3,19%; C%HCl = 1,31%
c. PTHH:
KOH + HCl → KCl + H2O
0,3 0,3
2KOH + FeCl2 → 2 KCl + Fe(OH)2↓
0,3 0,15 0,15
3 KOH + AlCl3 → 3KCl + Al(OH)3↓
0,6 0,2 0,2
KOH + Al(OH)3 → KAlO2 + 2H2O
0,2 0,2
![]()
0,15 0,075
Để lượng kết tủa không đổi thì KOH cần vừa đủ để hoà tan hết Al(OH)3
=> Tổng số mol KOH là: 0,3 + 0,3 + 0,6 + 0,2 = 1,4 mol
=> Khối lượng dung dịch KOH là: (1,4.56.100) : 15 = 522,67 gam.
=> m rắn = 0,075.160 = 12 gam.
Mời các bạn tải tài liệu về tham khảo.



