Lý thuyết Hóa học 12 bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại
VnDoc xin giới thiệu bài Lý thuyết Hóa học 12 bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại được chúng tôi sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Luyện tập điều chế kim loại và sự ăn mòn kim loại
1. Tóm tắt lý thuyết
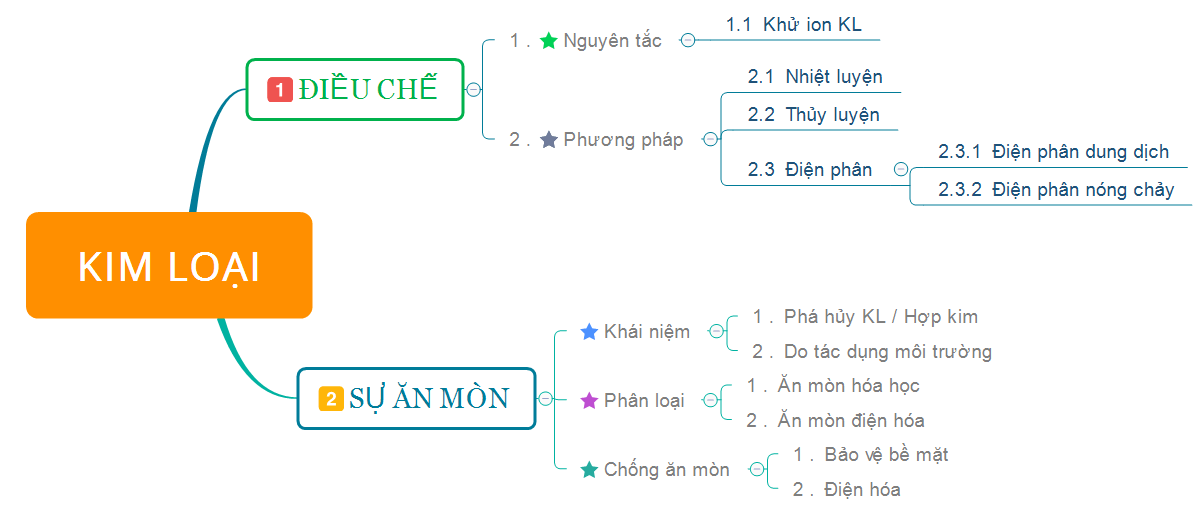
2. Bài tập minh họa
2.1. Bài tập Điều chế kim loại và Ăn mòn kim loại - Cơ bản
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Sục khí Cl2 vào dung dịch FeCl2.
(c) Dẫn khí H2 dư qua bột CuO nung nóng.
(d) Cho Na vào dung dịch CuSO4 dư.
(e) Nhiệt phân AgNO3.
(g) Đốt FeS2 trong không khí.
(h) Điện phân dung dịch CuSO4 với điện cực trơ.
Sau khi kết thúc các phản ứng,thí nghiệm nào thu được kim loại?
Hướng dẫn:(c) Dẫn khí H2 dư qua bột CuO nung nóng.
(e) Nhiệt phân AgNO3.
(h) Điện phân dung dịch CuSO4 với điện cực trơ.
Bài 2: Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl3, AgNO3. Nhúng vào mỗi dung dịch một thanh Ni. Số trường hợp xuất hiện ăn mòn điện hoá là:Xảy ra ăn mòn điện hóa phải thỏa mãn 3 điều kiện:
+) có 2 điện cực khác bản chất
+) 2 điện cực tiếp xúc trực tiếp hoặc gián tiếp với nhau
+) 2 điện cực được nhúng trong cùng một dung dịch chất điện ly
Có 2 trường hợp thỏa mãn: CuSO4; AgNO3
Bài 3: Nhúng một thanh nhôm nặng 45 gam vào 400 ml dung dịch CuSO4 0,5M. Sau một thời gian lấy thanh nhôm ra cân lại thấy nặng 46,38 gam. Khối lượng Cu thoát ra là:![]() \(\begin{matrix} 2Al & + & 3Cu^{2+} & \rightarrow & 2Al^{3+} & + & 3Cu\\ x & \rightarrow & 1,5x & & \rightarrow & & 1,5x \end{matrix}\)
\(\begin{matrix} 2Al & + & 3Cu^{2+} & \rightarrow & 2Al^{3+} & + & 3Cu\\ x & \rightarrow & 1,5x & & \rightarrow & & 1,5x \end{matrix}\)
⇒ msau - mtrước = 64 × 1,5x - 27x = 46,38 - 45
⇒ x = 0,02 mol ⇒ nCu pứ = 1,5 × 0,02 × 64 = 1,92 g
Do sau phản ứng dung dịch có pH = 0,3 ⇒ H+: nH+ = 0,05 mol
Catot: Cu2+ + 2e → Cu
Anot:
2Cl- - 2e → Cl2
2H2O - 4e → 4H+ + O2
⇒ bảo toàn e: ne = nCl- + nH+ = 2nCu2+
⇒ x = 0,125 mol
2.2. Bài tập Điều chế kim loại và Ăn mòn kim loại - Nâng cao
![]() \({n_{C{O_2}}} = {n_{BaC{O_3}}} = 0,046{\rm{ }}(mol)\)
\({n_{C{O_2}}} = {n_{BaC{O_3}}} = 0,046{\rm{ }}(mol)\)
Bảo toàn nguyên tố C ta có: ![]() \({n_{CO}} = {n_{C{O_2}}} = 0,046(mol)\)
\({n_{CO}} = {n_{C{O_2}}} = 0,046(mol)\)
Bảo toàn khối lượng:
 \(\begin{array}{l} {\rm{ }}{m_{hh}} + {m_{CO}} = {m_Y} + {m_{C{O_2}}}\\ \Leftrightarrow {m_{hh}} = {m_Y} + {m_{C{O_2}}} - {m_{CO}}\\ \Leftrightarrow {m_{hh}} = 4,784 + 0,046.44 - 0,046.28 = 5,52(gam) \end{array}\)
\(\begin{array}{l} {\rm{ }}{m_{hh}} + {m_{CO}} = {m_Y} + {m_{C{O_2}}}\\ \Leftrightarrow {m_{hh}} = {m_Y} + {m_{C{O_2}}} - {m_{CO}}\\ \Leftrightarrow {m_{hh}} = 4,784 + 0,046.44 - 0,046.28 = 5,52(gam) \end{array}\)
Gọi số mol của FeO và Fe2O3 lần lượt là x và y:
 \(\left\{ \begin{array}{l} x + y = 0,04\\ 72{\rm{x}} + 160y = 5,52 \end{array} \right. \Leftrightarrow \left\{ \begin{array}{l} x = 0,01{\rm{ }}(mol)\\ y = 0,03{\rm{ }}(mol) \end{array} \right.\)
\(\left\{ \begin{array}{l} x + y = 0,04\\ 72{\rm{x}} + 160y = 5,52 \end{array} \right. \Leftrightarrow \left\{ \begin{array}{l} x = 0,01{\rm{ }}(mol)\\ y = 0,03{\rm{ }}(mol) \end{array} \right.\)
![]() \(\% {m_{FeO}} = \frac{{0,01.72}}{{5,52}}.100 = 13,04\)
\(\% {m_{FeO}} = \frac{{0,01.72}}{{5,52}}.100 = 13,04\)
nNaCl = 0,4 mol
Catot: 2H2O → 2OH- + H2 - 2e
Anot: 2Cl- → Cl2 + 2e![]() \(\Rightarrow n_e = 2n_{Cl_2} = 2n_{H_2} và n_{H_2} + n_{Cl_2} = 0,3\ mol
\Rightarrow n_{H_2} = n_{Cl_2} = 0,15\ mol\)
\(\Rightarrow n_e = 2n_{Cl_2} = 2n_{H_2} và n_{H_2} + n_{Cl_2} = 0,3\ mol
\Rightarrow n_{H_2} = n_{Cl_2} = 0,15\ mol\)
⇒ nOH =0,3 mol
Lại có![]() \(n_{AlCl_3} = 0,085\ mol \Rightarrow 3n_{NaOH } < n_{OH} < 4n_{NaOH}\)
\(n_{AlCl_3} = 0,085\ mol \Rightarrow 3n_{NaOH } < n_{OH} < 4n_{NaOH}\)
⇒ kết tủa tan 1 phần: ![]() \(n_{Al(OH)_3} = 4n_{Al^{3+}} - n_{OH} = 0,04\ mol\)
\(n_{Al(OH)_3} = 4n_{Al^{3+}} - n_{OH} = 0,04\ mol\)
![]() \(\Rightarrow m_{Al(OH)_3} = 3,12\ g\)
\(\Rightarrow m_{Al(OH)_3} = 3,12\ g\)
--------------------------------------
Trên đây VnDoc.com vừa giới thiệu tới các bạn Lý thuyết Hóa học 12 bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại, mong rằng qua đây các bạn có thể học tập tốt hơn môn Hóa học nhé. Mời các bạn cùng tham khảo thêm kiến thức các môn: Toán 12, Vật lý 12, Giải bài tập Toán 12, Giải bài tập Hóa 12,...




