Lý thuyết Hóa học 12 bài 28: Luyện tập tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Chúng tôi xin giới thiệu bài Lý thuyết Hóa học 12 bài 28: Luyện tập tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Luyện tập tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
1. Vị trí của kim loại kiềm, kiềm thổ trong Bảng hệ thống tuần hoàn và cấu hình electron
| Vị trí trong Bảng tuần hoàn | Cấu hình electron lớp ngoài cùng | Tính chất hóa học đặc trưng | Điều chế | |
| Kim loại kiềm | Nhóm IA | ns1 |
Có tính khử mạnh nhất trong các kim loại
|
Điện phân muối halogen nóng chảy
|
| Kim loại kiềm thổ | Nhóm IIA | ns2 |
Có tính khử mạnh chỉ sau kim loại kiềm
|
2. Một số hợp chất quan trọng của kim loại kiềm, kiềm thổ và Nước cứng
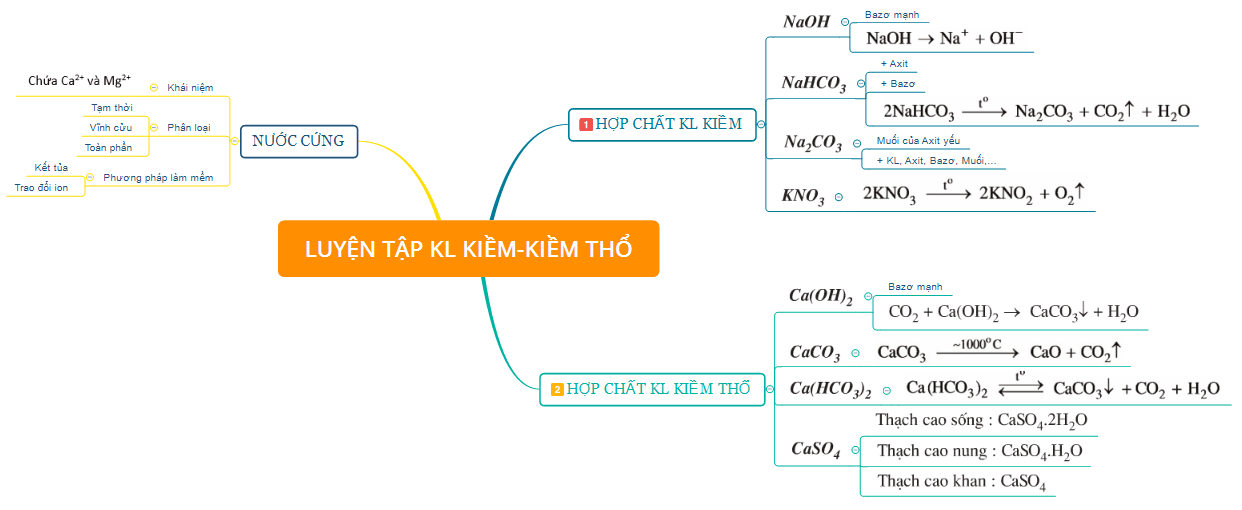
3. Bài tập minh họa
3.1. Bài tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng - Cơ bản
Các muối hidrocacbonat của kim loại kiềm và kiềm thổ đều bị phân hủy tạo muối cacbonat khi ở nhiệt độ không quá cao, tuy nhiên chỉ có muối cacbonat của kim loại kiềm thổ mới bị thủy phân ở nhiệt độ cao tạo oxit kim loại.
⇒ Nhiệt phân hỗn hợp ban đầu sẽ thu được: CaO; Na2CO3.
Bài 2: Cho các chất: Na2CO3; NaHCO3; NaHSO4; HCl; BaCl2; CuO; Fe. Số cặp chất có thể tác dụng trực tiếp với nhau ở nhiệt độ thường là:Các cặp chất: (Na2CO3 + NaHSO4); (Na2CO3 + HCl); (Na2CO3 + BaCl2); (NaHCO3 + NaHSO4); (NaHCO3 + HCl); (NaHSO4 + BaCl2); (NaHSO4 + CuO); (NaHSO4 + Fe); (HCl + CuO); (HCl + Fe).
Bài 3: Hòa tan hoàn toàn 14,52 gam hỗn hợp X gồm NaHCO3, KHCO3 và MgCO3 bằng dd HCl dư, thu được 3,36 lít khí CO2 (đktc) và dd chứa m gam muối KCl. Giá trị của m là:Coi hỗn hợp gồm KHCO3 và MgCO3 có số mol lần lượt là x và y (vì ![]() \(M_{NaHCO_{3}}= M_{MgCO_{3}}\))
\(M_{NaHCO_{3}}= M_{MgCO_{3}}\)) \(\\ n_{CO_{2}}= 0,15 \ mol \Rightarrow x + y = 0,15 \\ 100x + 84y = 14,52 \\ \Rightarrow x = 0,12 ; \ y = 0,03 \\ \Rightarrow m = 0,12 . (39 + 35,5) = 8,94 \ g\)
\(\\ n_{CO_{2}}= 0,15 \ mol \Rightarrow x + y = 0,15 \\ 100x + 84y = 14,52 \\ \Rightarrow x = 0,12 ; \ y = 0,03 \\ \Rightarrow m = 0,12 . (39 + 35,5) = 8,94 \ g\)
3.2. Bài tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng - Nâng cao
Hướng dẫn:
Dạng toán CO2 tác dụng với hỗn hợp bazơ của kim loại nhóm kiềm – kiềm thổ.
 \(\begin{array}{l} {n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\\ {n_{O{H^ - }}} = {n_{NaOH}} + 2.{n_{Ba{{(OH)}_2}}} = 0,15 + 2.0,1 = 0,25(mol) \end{array}\)
\(\begin{array}{l} {n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\\ {n_{O{H^ - }}} = {n_{NaOH}} + 2.{n_{Ba{{(OH)}_2}}} = 0,15 + 2.0,1 = 0,25(mol) \end{array}\)
Vì: ![]() \({n_{C{O_2}}} < {n_{O{H^ - }}} < 2{n_{C{O_2}}} \Rightarrow {n_{C{O_3}^{2 - }}} = {n_{O{H^ - }}} - {n_{C{O_2}}}\)
\({n_{C{O_2}}} < {n_{O{H^ - }}} < 2{n_{C{O_2}}} \Rightarrow {n_{C{O_3}^{2 - }}} = {n_{O{H^ - }}} - {n_{C{O_2}}}\)
![]() \({n_{HC{O_3}^ - }} = {n_{C{O_2}}} - {n_{C{O_3}^{2 - }}}\)
\({n_{HC{O_3}^ - }} = {n_{C{O_2}}} - {n_{C{O_3}^{2 - }}}\)
![]() \(\Rightarrow {n_{C{O_3}^{2 - }}} = 0,15mol; có {n_{Ba{{\left( {OH} \right)}_2}}} = 0,1mol\)
\(\Rightarrow {n_{C{O_3}^{2 - }}} = 0,15mol; có {n_{Ba{{\left( {OH} \right)}_2}}} = 0,1mol\)
![]() \({n_{BaC{{\rm{O}}_3}}} = 0,1mol\)
\({n_{BaC{{\rm{O}}_3}}} = 0,1mol\)
Vậy ![]() \({m_{BaC{O_3}}} = 19,700g\)
\({m_{BaC{O_3}}} = 19,700g\)
Quy hỗn hợp X về Ba, Na và O.![]() \({{\rm{n}}_{{\rm{Ba}}}}{\rm{ = }}{{\rm{n}}_{{\rm{Ba(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,72 mol; }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}}}{\rm{ = 0,3 mol}}\)
\({{\rm{n}}_{{\rm{Ba}}}}{\rm{ = }}{{\rm{n}}_{{\rm{Ba(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,72 mol; }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}}}{\rm{ = 0,3 mol}}\)
Đặt nNa = x (mol) , nO = y (mol)
BTKL: mNa + mO = mX - mBa ⇔ 23x + 16y = 32,76 (1)
BT electron: ne nhường = ne nhận
(ở đây Na, Ba nhường e, O nhận e về O2-, H+ nhận e thành H2 bay lên)
⇔ x + 2 .0,72 = 2y + 0,3. 2 (2)
Từ (1) và (2) ta có hệ phương trình:
![]() \(\left\{ \begin{array}{l} 23x{\rm{ }} + {\rm{ }}16y{\rm{ }} = {\rm{ }}32,76\;\;\\ x{\rm{ - 2y }} = - 0,84 \end{array} \right. \Leftrightarrow \left\{ \begin{array}{l} x = 0,84\\ y = 0,84 \end{array} \right.\)
\(\left\{ \begin{array}{l} 23x{\rm{ }} + {\rm{ }}16y{\rm{ }} = {\rm{ }}32,76\;\;\\ x{\rm{ - 2y }} = - 0,84 \end{array} \right. \Leftrightarrow \left\{ \begin{array}{l} x = 0,84\\ y = 0,84 \end{array} \right.\)
⇒ nOH- = nNa + 2nBa = 2,28 mol![]() \(n_{CO_2}=1,8\ mol\)
\(n_{CO_2}=1,8\ mol\)![]() \(\Rightarrow n_{{CO_3}^{2-}}=0,48\ mol,\ n_{{HCO_3}^-}=1,32\ mol\)
\(\Rightarrow n_{{CO_3}^{2-}}=0,48\ mol,\ n_{{HCO_3}^-}=1,32\ mol\)![]() \(\Rightarrow n_{BaCO_3}=0,48\ mol \Rightarrow m_{BaCO_3}=94,56\ g\)
\(\Rightarrow n_{BaCO_3}=0,48\ mol \Rightarrow m_{BaCO_3}=94,56\ g\)
--------------------------------------
Trên đây VnDoc.com vừa giới thiệu tới các bạn Lý thuyết Hóa học 12 bài 28: Luyện tập tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng, mong rằng qua đây các bạn có thể học tập tốt hơn môn Hóa học nhé. Mời các bạn cùng tham khảo thêm kiến thức các môn: Toán 12, Vật lý 12, Giải bài tập Toán 12, Giải bài tập Hóa 12,...




