Lý thuyết Hóa học 12 bài 29: Luyện tập tính chất của nhôm và hợp chất của nhôm
Lý thuyết Hóa học 12 bài 29: Luyện tập tính chất của nhôm và hợp chất của nhôm được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Luyện tập tính chất của nhôm và hợp chất của nhôm
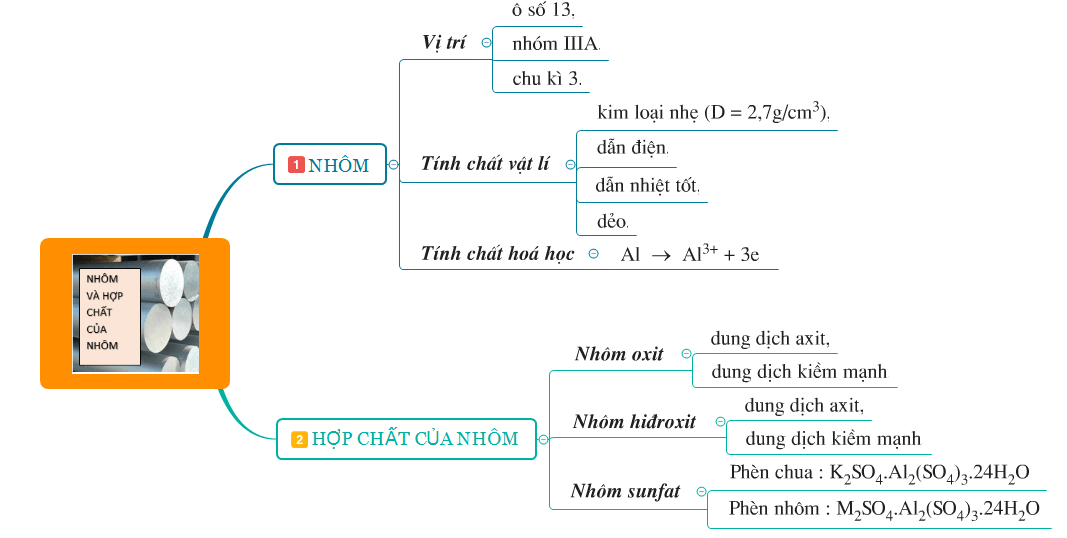
1. Tóm tắt lý thuyết
2. Bài tập Tính chất của nhôm và hợp chất của nhôm - Cơ bản
Bài 1: Có 3 chất rắn là: Mg, Al, Al2O3. Hãy nhận biết mỗi chất đã cho bằng phương pháp hóa học. Viết các phương trình hóa học.
Hướng dẫn:
Cho 3 chất rắn vào 3 ống nghiệm đựng dung dịch NaOH riêng biệt. Nếu có khí bay lắm lên, đó là Al. Nếu chất rắn tan, đó là Al2O3. Nếu không có hiện tượng gì là Mg
Phương trình hóa học của các phản ứng.
![\begin{array}{l} 2Al{\rm{ }} + {\rm{ }}2NaOH{\rm{ }} + {\rm{ }}6{H_2}O \to 2Na[Al{(OH)_4}{\rm{]}} + 3{H_2} \uparrow \\ A{l_2}{{\rm{O}}_3}{\rm{ }} + {\rm{ }}2NaOH{\rm{ }} + {\rm{ 3}}{H_2}O \to 2Na[Al{(OH)_4}{\rm{]}} \end{array}](https://st.vndoc.com/data/image/blank.png) \(\begin{array}{l} 2Al{\rm{ }} + {\rm{ }}2NaOH{\rm{ }} + {\rm{ }}6{H_2}O \to 2Na[Al{(OH)_4}{\rm{]}} + 3{H_2} \uparrow \\ A{l_2}{{\rm{O}}_3}{\rm{ }} + {\rm{ }}2NaOH{\rm{ }} + {\rm{ 3}}{H_2}O \to 2Na[Al{(OH)_4}{\rm{]}} \end{array}\)
\(\begin{array}{l} 2Al{\rm{ }} + {\rm{ }}2NaOH{\rm{ }} + {\rm{ }}6{H_2}O \to 2Na[Al{(OH)_4}{\rm{]}} + 3{H_2} \uparrow \\ A{l_2}{{\rm{O}}_3}{\rm{ }} + {\rm{ }}2NaOH{\rm{ }} + {\rm{ 3}}{H_2}O \to 2Na[Al{(OH)_4}{\rm{]}} \end{array}\)
Bài 2: Cho m gam Al tan hoàn toàn vào dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z. Giá trị của m là:
Hướng dẫn:
Dung dịch Z gồm:
 \(\, \left\{\begin{matrix} AlCl_{3} : x \ (mol ) \\ HCl: x \ (mol) \ \end{matrix}\right. \Rightarrow 4x = y \ (BTNT \ Cl)\)
\(\, \left\{\begin{matrix} AlCl_{3} : x \ (mol ) \\ HCl: x \ (mol) \ \end{matrix}\right. \Rightarrow 4x = y \ (BTNT \ Cl)\)
Theo sơ đồ khi cho 5,16 mol NaOH vào dung dịch Z thì xảy ra 3 phản ứng và thu được 0,7x mol Al(OH)3
⇒ Số mol NaAlO2 = 0,3x mol
⇒ x + 3.0,7x + 4.0,3x = 5,16 ⇒ x = 1,2 mol ⇒ Số mol Al ban đầu = 1,2 ⇒ m = 32,4 gam
Bài 3: Cho 100 ml dung dịch hỗn hợp Al2(SO4)3 1M và CuSO4 1M tác dụng với dung dịch NaOH dư. Kết tủa thu được đem nung đến khối lượng không đổi thu được chất rắn có khối lượng là:
Hướng dẫn:
nAl2(SO4)3 = 0,1\mol
nCuSO4 = 0,1\mol
Do tác dụng dd NaOH dư nên Al(OH)3 tan chỉ còn lại Cu(OH)2![]() \(n_{CuSO_4} = n_{Cu(OH)_2} = 0,1\)
\(n_{CuSO_4} = n_{Cu(OH)_2} = 0,1\)![\begin{matrix} CuSO_4 & \xrightarrow[]{t^0} & CuO & + & H_2O\\ 0,1 & \rightarrow & 0,1 \end{matrix}](https://st.vndoc.com/data/image/blank.png) \(\begin{matrix} CuSO_4 & \xrightarrow[]{t^0} & CuO & + & H_2O\\ 0,1 & \rightarrow & 0,1 \end{matrix}\)
\(\begin{matrix} CuSO_4 & \xrightarrow[]{t^0} & CuO & + & H_2O\\ 0,1 & \rightarrow & 0,1 \end{matrix}\)
mchất rắn = 0,1 × 80 = 8 g
3. Bài tập Tính chất của nhôm và hợp chất của nhôm - Nâng cao
Bài 1: Hoà tan hoàn toàn 47,4 gam phèn chua KAl(SO4)2.12H2O vào nước, thu được dung dịch X. Cho toàn bộ X tác dụng với 200 ml dung dịch Ba(OH)2 1M, sau phản ứng thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
n phèn chua = ![]() \(\frac{47,4}{474}\) = 0,1 mol
\(\frac{47,4}{474}\) = 0,1 mol![]() \(n_{KAl(SO_4)_2.12H_2O} = m_{KAl(SO_4)_2} = 0,1\)
\(n_{KAl(SO_4)_2.12H_2O} = m_{KAl(SO_4)_2} = 0,1\)
nBa(OH)2 = 0,2 mol
 \(\begin{matrix} KAl(SO_4)_2 & \rightarrow & K^+ & + & Al^{3+} & + & 2{SO_4}^{2-}\\ 0,1 & \rightarrow & 0,1 & & 0,1 & & 0,2 \end{matrix}\)
\(\begin{matrix} KAl(SO_4)_2 & \rightarrow & K^+ & + & Al^{3+} & + & 2{SO_4}^{2-}\\ 0,1 & \rightarrow & 0,1 & & 0,1 & & 0,2 \end{matrix}\) \(\begin{matrix} Ba(OH)_2 & \rightarrow & Ba^{2+} & + & 2OH^-\\ 0,2 & \rightarrow & 0,2 & & 0,4 \end{matrix}\)
\(\begin{matrix} Ba(OH)_2 & \rightarrow & Ba^{2+} & + & 2OH^-\\ 0,2 & \rightarrow & 0,2 & & 0,4 \end{matrix}\) \(\begin{matrix} Ba^{2+} & + & {SO4}^{2-} & \rightarrow & BaSO_4\downarrow\\ 0,2 & & 0,2 & \rightarrow & 0,2 \end{matrix}\)
\(\begin{matrix} Ba^{2+} & + & {SO4}^{2-} & \rightarrow & BaSO_4\downarrow\\ 0,2 & & 0,2 & \rightarrow & 0,2 \end{matrix}\) \(\begin{matrix} Al^{3+} & + & 3OH^- & \rightarrow & Al(OH)_3\downarrow\\ 0,1 & \rightarrow & 0,3 & & 0,1\\ & & du\ 0,1 \end{matrix}\)
\(\begin{matrix} Al^{3+} & + & 3OH^- & \rightarrow & Al(OH)_3\downarrow\\ 0,1 & \rightarrow & 0,3 & & 0,1\\ & & du\ 0,1 \end{matrix}\) \(\begin{matrix} Al(OH)_3 & + & OH^- & \rightarrow & {AlO2}^- & + & H_2O\\ 0,1 & \gets & 0,1 \end{matrix}\)
\(\begin{matrix} Al(OH)_3 & + & OH^- & \rightarrow & {AlO2}^- & + & H_2O\\ 0,1 & \gets & 0,1 \end{matrix}\)
Vây kết tủa chỉ còn BaSO4↓ ![]() \(m_{BaSO_4} = 0,2 \times 233 = 46,6\ g\)
\(m_{BaSO_4} = 0,2 \times 233 = 46,6\ g\)
Bài 2: Dung dịch A là dung dịch NaOH. Lấy 100 ml dung dịch A trộn với 400 ml dung dịch AlCl3 0,1M thì lượng kết tủa sinh ra bằng với lượng kết tủa khi lấy 500 ml dung dịch A trộn với 400 ml dung dịch AlCl3 0,1M. Giá trị CM dung dịch NaOH là:
Hướng dẫn:
Đặt ![]() \(C_{M_{NaOH}} = x M\)
\(C_{M_{NaOH}} = x M\)
⇒ nNaOH (100ml) = 0,1x mol
nNaOH (500ml) = 0,5x mol![]() \(n_{AlCl_3} = 0,4 \times 0,1 = 0,04\ mol\)
\(n_{AlCl_3} = 0,4 \times 0,1 = 0,04\ mol\)
Lượng kết tủa 2 TN bằng nhau ⇒
- TN1: Kết tủa chưa cực đại, OH- hết.
- TN2: Kết tủa cực đại và tan 1 phần. \(\begin{matrix} & Al3+ & + & 3OH- & \rightarrow & Al(OH)3 \downarrow\\ I: & & & 0,1x & \rightarrow & \frac{0,1x}{3}\\ II: & 0,04 & \rightarrow & 0,12 & \rightarrow& 0,04 \end{matrix}\)(cực đại)
\(\begin{matrix} & Al3+ & + & 3OH- & \rightarrow & Al(OH)3 \downarrow\\ I: & & & 0,1x & \rightarrow & \frac{0,1x}{3}\\ II: & 0,04 & \rightarrow & 0,12 & \rightarrow& 0,04 \end{matrix}\)(cực đại) \(\begin{matrix} & Al(OH)_3 & + & OH^- & \rightarrow & {AlO_2}^- & + & 2H_2O\\ tan & y & \rightarrow & y \end{matrix}\)
\(\begin{matrix} & Al(OH)_3 & + & OH^- & \rightarrow & {AlO_2}^- & + & 2H_2O\\ tan & y & \rightarrow & y \end{matrix}\)
⇒ \(\begin{matrix} 0,04 - y = \frac{0,1x}{3}\ (1)\\ 0,12 + y = 0,5x\ (2) \end{matrix}\)
\(\begin{matrix} 0,04 - y = \frac{0,1x}{3}\ (1)\\ 0,12 + y = 0,5x\ (2) \end{matrix}\)
Từ (1), (2) ⇒ x = 0,3; y = 0,3![]() \(\Rightarrow C_{M_{NaOH}} = 0,3\)
\(\Rightarrow C_{M_{NaOH}} = 0,3\)
--------------------------------------
Trên đây VnDoc.com vừa giới thiệu tới các bạn Lý thuyết Hóa học 12 bài 29: Luyện tập tính chất của nhôm và hợp chất của nhôm, mong rằng qua đây các bạn có thể học tập tốt hơn môn Hóa học nhé. Mời các bạn cùng tham khảo thêm kiến thức các môn: Toán 12, Vật lý 12, Giải bài tập Toán 12, Giải bài tập Hóa 12,...