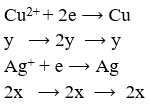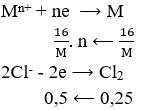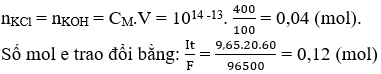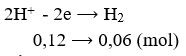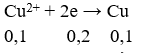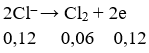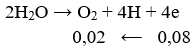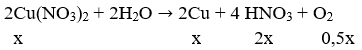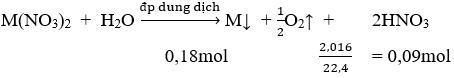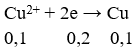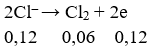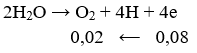1
Điện phân hoàn toàn 200 ml một dung dịch chứa 2 muối là Cu(NO3)2 và AgNO3 với I = 0,804A, thời gian điện phân là 2 giờ, người ta nhận thấy khối lượng cực âm tăng thêm 3,44 g. Nồng độ mol của mỗi muối trong dung dịch ban đầu lần lượt là:
Số mol e trao đổi bằng:
Đặt 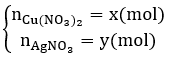
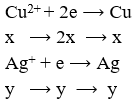
Khối lượng cực âm tăng thêm chính là tổng khối lượng Ag và Cu nên có hệ:
Nồng độ mol của mỗi muối trong dung dịch ban đầu lần lượt là:
CM(Cu(NO3)2 = 0,02: (200/1000) = 0,1 (M);
CM(AgNO3) = 0,02: (200/1000) = 0,1 (M)
→ Đáp án B