Wiki tính chất hóa học của Kali
Wiki tính chất hóa học của Kali được VnDoc sưu tầm và đăng tải, tổng hợp các câu hỏi lí thuyết trong chương trình giảng dạy môn Hóa học. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Tính chất hóa học của Kali
I. Định nghĩa
- Kali là một kim loại kiềm được phát hiện bởi Sir Humphry Davy năm 1807, ông tách nó ra từ dung dịch KOH. Kim loại kiềm này là kim loại đầu tiên được điều chế bằng điện phân.
- Kí hiệu: K
- Cấu hình electron: [Ar] 4s1
- Số hiệu nguyên tử: 19
- Khối lượng nguyên tử: 39 g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: số 19
+ Nhóm: IA
+ Chu kì: 4
- Đồng vị: 39K, 40K, 41K.
- Độ âm điện: 0,82
II. Tính chất vật lí & nhận biết
1. Tính chất vật lí:
- Kali là kim loại nhẹ thứ hai sau liti, là chất rắn rất mềm, dễ dàng cắt bằng dao và có màu trắng bạc.
- Kali bị ôxi hóa rất nhanh trong không khí và phải được bảo quản trong dầu mỏ hay dầu lửa.
- Có khối lượng riêng là 0,863 g/cm3; có nhiệt độ nóng chảy là 63,51oC và sôi ở 760oC.
2. Nhận biết
- Đốt cháy các hợp chất của Kali, cho ngọn lửa màu tím.
III. Tính chất hóa học
- Kali là kim loại kiềm có tính khử rất mạnh.
K → K+ + 1e
a. Tác dụng với phi kim
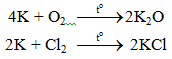
b. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
c. Tác dụng với nước
- K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
d. Tác dụng với hidro
- Kali tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
IV. Trạng thái tự nhiên
- Dạng tự nhiên của K có 3 đồng vị: K39 (93,3%), K40(0,01%) và K41 (6,7%).
- Nguyên tố này chiếm khoảng 2,4% trọng lượng lớp vỏ Trái Đất và là nguyên tố phổ biến thứ bảy trong lớp này. Vì tính không hòa tan của nó, rất khó thu được kali từ các khoáng chất của nó.
V. Điều chế
- Kali có thể điều chế nhờ điện phân nóng chảy kali clorua
![]()
VI. Ứng dụng
- Các loại phân hóa học chứa kali như clorua kali, sulfat kali, cacbonat kali v.v ………
+ Nitrat kali được sử dụng trong thuốc súng.
+ Cacbonat kali được sử dụng trong sản xuất thủy tinh.
+ Thủy tinh được xử lý bằng kali lỏng là có độ bền cao hơn so với thủy tinh thường.
+ NaK là hợp kim của kali với natri được sử dụng như là chất truyền nhiệt trung gian.
+ Nguyên tố này là thành phần rất cần thiết cho sự phát triển của cây cối và được tìm thấy trong nhiều loại đất
VII. Các hợp chất quan trọng của Kali
- Kali hiđroxit: KOH
Wiki tính chất hóa học của Kali trên đây được VnDoc sưu tầm và giới thiệu nhằm giúp các em học sinh hiểu rõ hơn về tính chất hóa học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đã học trong chương trình Hóa học.










