Bảng tuần hoàn các nguyên tố hóa học
Chuyên đề Hóa học lớp 9: Bảng tuần hoàn các nguyên tố hóa học được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh giải bài tập Hóa học lớp 9 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Bảng tuần hoàn các nguyên tố hóa học
- I. Bảng tuần hoàn các nguyên tố hóa học
- II. Ô nguyên tố
- III. Chu kì
- IV. Mối quan hệ giữa các nguyên tố trong bảng tuần hoàn
- V. So sánh tính chất của các nguyên tố trong bảng tuần hoàn
- VI. Mối quan hệ giữa cấu hình e nguyên tử và tính chất của nguyên tố
- VII. Mối quan hệ giữa cấu hình e với vị trí của nguyên tố
- VIII. Các Mẹo Học Bảng Hệ Thống Tuần Hoàn Hóa Học
Bảng tuần hoàn các nguyên tố hóa học hay bảng hệ thống tuần hoàn các nguyên tố hóa học, hay bảng tuần hoàn Mendeleev, hay ngắn gọn bảng tuần hoàn, là một phương pháp liệt kê các nguyên tố hóa học thành bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng.
I. Bảng tuần hoàn các nguyên tố hóa học
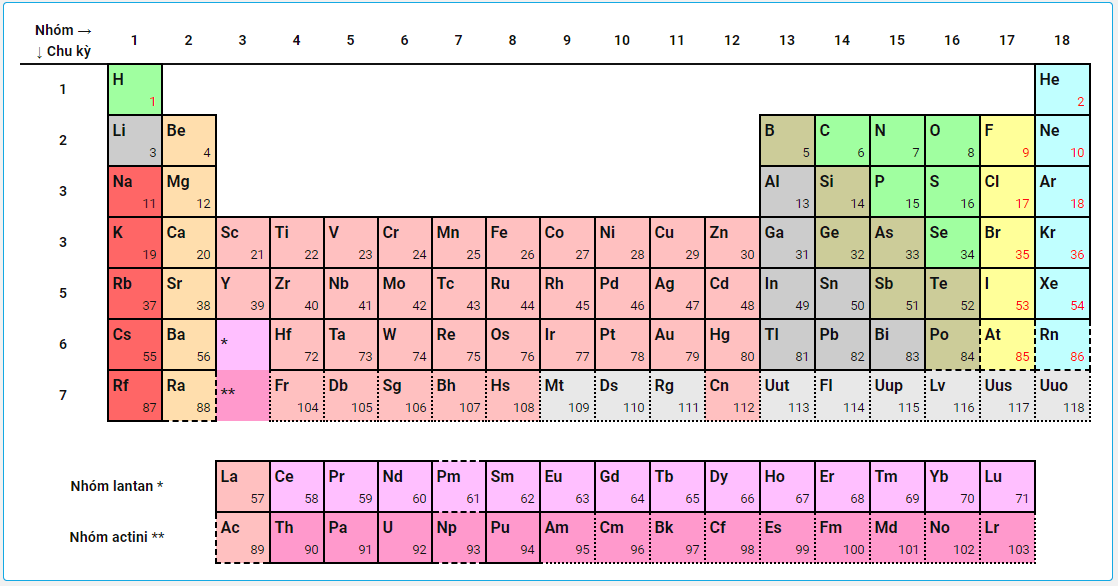
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp xếp thành một hàng.
- Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột.
Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Tỷ lệ xuất hiện tự nhiên
-
Viền liền: Có đồng vị già hơn Trái Đất (chất nguyên thủy) -
Viền gạch gạch: Thường sinh ra từ phản ứng phân rã các nguyên tố khác, không có đồng vị già hơn Trái Đất (hiện tượng hóa học) -
Viền chấm chấm: Tạo ra trong phòng thí nghiệm (nguyên tố nhân tạo) - Không có viền: chưa tìm thấy
Cấu tạo bảng tuần hoàn
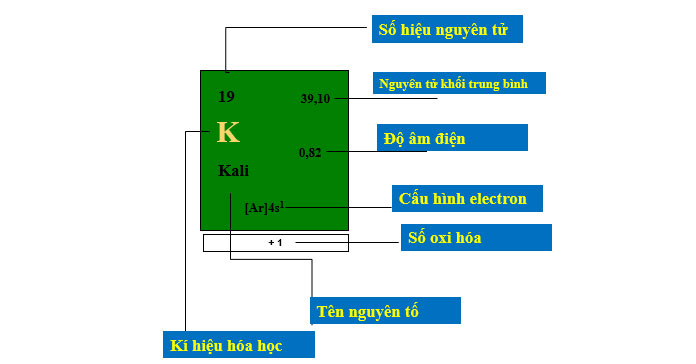
1. Ô nguyên tố
- Mỗi nguyên tố hóa học chiếm 1 ô trong bảng tuần hoàn được gọi là ô nguyên tố.
- Số thứ tự ô nguyên tố = số hiệu nguyên tử của nguyên tố (= số e = số p = số đơn vị điện tích hạt nhân).
2. Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp e, được xếp theo chiều tăng dần của điện tích hạt nhân).
- Số thứ tự chu kì = số lớp e.
- Bảng tuần hoàn hiện có 7 chu kì được đánh số từ 1 đến 7:
+ Chu kì 1,2,3: chu kì nhỏ
+ Chu kì 4,5,6,7: chu kì lớn
+ Chu kì 7 chưa hoàn thành
3. Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình e tương tự nhau do đó có tính chất hóa học gần giống nhau và được xếp thành 1 cột
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B
4. Khối nguyên tố (block)
- Các nguyên tố trong bảng tuần hoàn thuộc 4 khối: khối s, khối p, khối d và khối f.
- e cuối cùng điền vào phân lớp nào (theo thứ tự mức năng lượng) thì nguyên tố thuộc khối đó.
II. Ô nguyên tố

Số thứ tự nguyên tố = số đơn vị điện tích hạt nhân (Z) = số proton = số electron trong nguyên tử.
III. Chu kì
Chu kì là dãy các nguyên tố của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần
Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
Bảng tuần hoàn gồm có 7 chu kì
| STT | Nguyên tố bắt đầu | Nguyên tố kết thúc | Số nguyên tố |
| 1. | H (Z = 1): 1s1 | He (Z = 2): 1s2 | 2 |
| 2. | Li (Z = 3) | Ne (Z = 10) | 8 |
| 3. | Na (Z = 11) | Ar (Z = 18) | 8 |
| 4. | K (Z = 19) | Kr (Z = 36) | 18 |
| 5. | Rb (Z =37) | Xe (Z = 54) | 18 |
| 6. | Cs (Z = 55) | Rn (Z = 86) | 32 |
| 7. | Fr (Z = 87) | Chưa xác định | Chưa hoàn thiện |
IV. Mối quan hệ giữa các nguyên tố trong bảng tuần hoàn
Vị trí của các nguyên tố trong bảng tuần hoàn có mối quan hệ với nhau.
Cụ thể là:
– Nếu 2 nguyên tố A và B ở cùng 1 chu kì và ở 2 nhóm A liên tiếp thì:
|ZA – ZB| = 1 nếu nguyên tố thuộc chu kì nhỏ
|ZA – ZB| = 11 nếu nguyên tố thuộc chu kì lớn và ở nhóm IIA và IIIA
– Nếu 2 nguyên tố thuộc cùng một nhóm A và ở 2 chu kì liên tiếp thì:
|ZA – ZB| = 8 nếu nguyên tố thuộc chu kì nhỏ
|ZA – ZB| = 18 nếu có nguyên tố thuộc chu kì lớn
– Nếu 2 nguyên tố thuộc 2 chu kì liên tiếp và ở 2 nhóm A liên tiếp thì:
|ZA – ZB| = 7 (9 hoặc 17, 19)
V. So sánh tính chất của các nguyên tố trong bảng tuần hoàn
Theo định luật tuần hoàn thì tính chất của các đơn chất cũng như thành phần và tính chất của các hợp chất tạo bởi chúng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân. Như vậy nhiều tính chất của các nguyên tố trong bảng tuần hoàn biến đổi có quy luật theo chu kì và theo nhóm. Dựa vào vị trí tương đối của các nguyên tố trong bảng tuần hoàn, chúng ta có thể so sánh được tính chất của các nguyên tố đó và hợp chất của chúng. Dưới đây là bảng tóm tắt sự biến đổi tuần hoàn của một số tính chất thường gặp theo chu kì và nhóm A:
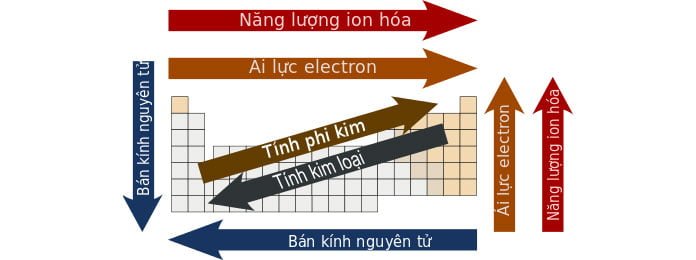
Cụ thể là:
| Tính chất | Bán kính nguyên tử | Độ âm điện | Tính kim loại | Tính phi kim | Tính bazơ của oxit, hidroxit | Tính axit của oxit, hidroxit | Số e lớp ngoài cùng |
| Theo chu kì | ↓ | ↑ | ↓ | ↑ | ↓ | ↑ | ↑ từ 1 đến 8 |
| Theo nhóm A | ↑ | ↓ | ↑ | ↓ | ↑ | ↓ | = STT nhóm A |
Chú ý:
Khi cần phải so sánh tính chất của các nguyên tố không cùng chu kì hoặc nhóm A thì phải chọn nguyên tố trung gian rồi đưa về cùng hàng, cột để so sánh hoặc loại trừ.
VI. Mối quan hệ giữa cấu hình e nguyên tử và tính chất của nguyên tố
Dựa vào cấu hình electron nguyên tử của nguyên tố có thể xác định được một số tính chất đặc trưng của nguyên tố đó. Cụ thể là:
Loại nguyên tố
– Nguyên tử có 1, 2, 3 e ở lớp ngoài cùng: là nguyên tố kim loại (trừ H, He).
– Nguyên tử có 5, 6, 7 e ở lớp ngoài cùng: thường là nguyên tố phi kim.
– Nguyên tử có 8e ở lớp ngoài cùng: là nguyên tố khí hiếm (cả trường hợp He có 2e).
– Nguyên tử có 4e ở lớp ngoài cùng là phi kim nếu thuộc chu kì 2, 3 và là kim loại nếu thuộc các chu kì khác.
Công thức một số loại hợp chất và tính chất của hợp chất đó
Nếu nguyên tố R thuộc nhóm nA:
– Hóa trị trong oxit cao nhất là n → công thức oxit cao nhất là R2On.
– Hóa trị trong hợp chất khí với H (chỉ áp dụng với phi kim) là (8 – n) → công thức hợp chất khí với H là RH8-n.
– Công thức hidroxit cao nhất: R(OH)n (nếu n < 4 thì giữ nguyên công thức; nếu n > 3 thì chuyển thành dạng axit HnROn và tối giản công thức bằng cách bớt đi số phân tử H2O phù hợp).
– Nếu n < 4: oxit và hidroxit cao nhất thường có tính bazơ; nếu n > 3: oxit và hidroxit cao nhất thường có tính axit.
VII. Mối quan hệ giữa cấu hình e với vị trí của nguyên tố
Giữa cấu hình electron nguyên tử và vị trí của nguyên tố trong bảng tuần hoàn có mối quan hệ qua lại với nhau. Dựa vào cấu hình electron nguyên tử của nguyên tố có thể xác định được vị trí của nguyên tố đó trong bảng tuần hoàn và ngược lại. Cụ thể như sau:
– Số thứ tự ô nguyên tố = tổng số e của nguyên tử.
– Số thứ tự chu kì = số lớp e.
– Số thứ tự nhóm:
+ Nếu cấu hình e lớp ngoài cùng có dạng nsanpb (a = 1 → 2 và b = 0 → 6): Nguyên tố thuộc nhóm (a + b)A.
+ Nếu cấu hình e kết thúc ở dạng (n – 1)dxnsy (x = 1 → 10; y = 1 → 2): Nguyên tố thuộc nhóm B:
* Nhóm (x + y)B nếu 3 ≤ (x + y) ≤ 7.
* Nhóm VIIIB nếu 8 ≤ (x + y) ≤ 10.
* Nhóm (x + y – 10)B nếu 10 < (x + y).
VIII. Các Mẹo Học Bảng Hệ Thống Tuần Hoàn Hóa Học
1. Học bảng tuần hoàn bằng thơ
Cùng học thuộc bảng hệ thống tuần hoàn của các nguyên tố hóa học băng những vần thơ “chế” dưới đấy các em nhé.
Bài 1: Nhóm nguyên tố có số thứ tự 1-20:
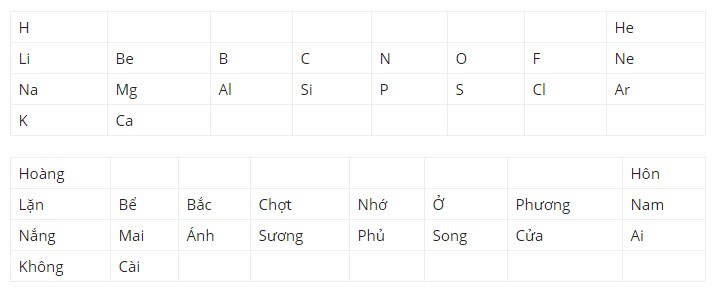
Học bảng tuần hoàn bằng thơ

Bài 2 : Nhóm nguyên tố có số thứ tự 21-30:
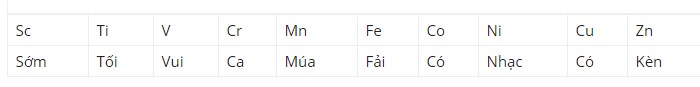

2. Cách học bảng tuần hoàn hóa học bằng câu vần
Rất nhiều các ẹo học rất thú vị và hữu ích được các thế hệ học sinh chia sẻ. Những phương pháp này có một điểm chung là từ các ký hiệu nguyên tố khô khan “chế” thành các từ có ý nghĩa và ghép thành các câu thơ hài hước.
Cách 1: Dãy hóa trị

Cách 2 :

Trên đây VnDoc đã giới thiệu tới các bạn Bảng tuần hoàn các nguyên tố hóa học. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 9, Giải bài tập Hóa học lớp 9, Giải bài tập Vật Lí 9, Tài liệu học tập lớp 9 mà VnDoc tổng hợp và đăng tải.