Hóa 9 bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Hóa 9 bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học được VnDoc biên soạn tổng hợp trọng tâm kiến thức lý thuyết bài 31 hóa 9. Tài liệu giúp các bạn nắm được kiến thức, từ đó biết cách vận dụng giải bài tập liên quan hiệu quả. Mời các bạn tham khảo.
A. Tóm tắt lý thuyết Bài 31 Hóa 9
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Sắp xếp các nguyên tố theo chiều tăng dần của điện tích hạt nhân nguyên tử.
II. Cấu tạo bảng tuần hoàn
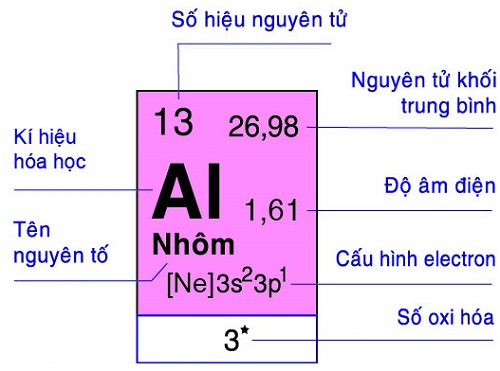
1. Ô nguyên tố
Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
Số hiệu nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử.
2. Chu kì
Là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
Số thứ tự chu kì bằng số lớp electron. Thí dụ:
Chu kì 1: Gồm 2 nguyên tố H và He, có 1 lớp electron trong nguyên tử. Điện tích hạt nhân tăng dần từ 1+ đến He là 2+
Chu kì 2: Gồm 8 nguyên tố từ Li đến Ne, có 2 lớp electron trong nguyên tử. Điện tích hạt nhân tăng dần từ Li là +2 đến Ne là +10
Chu kì 3: Gồm 8 nguyên tố từ Na đến Ar, có 3 lớp electron trong nguyên tử. Điện tích hạt nhân tăng dần từ Na là +11 đến Ar là +18
3. Nhóm
Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau, do đó có tính chất tương tự nhau.
Số thứ tự của các nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử trong nhóm đó. Thí dụ:
Nhóm I:
Gồm các nguyên tố kim loại hoạt động mạnh. Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng.
Điện tích hạt nhân tăng từ Li (3+) đến Fr (87+)
Nhóm VII:
Gồm các nguyên tố phi kim hoạt động mạnh. Nguyên tử của chúng đều có 7 electron ở lớp ngoài cùng.
Điện tích hạt nhân tăng từ F (9+) đến At (85+)
III. Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
1. Trong một chu kì
Số e lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
Thí dụ:
Chu kì 2 gồm 8 nguyên tố:
Số e lớp ngoài cùng của nguyên tử các nguyên tố tăng dần từ 1 đến 8
Tính kim loại giảm dần, đồng thời tính phi kim tăng dần. Đầu chu kì là kim loại mạnh cuối chu kì là phi kim mạnh.
| 2 |
3 Li Liti 7 |
4 Be Beri 9 |
5 B Bo 11 |
6 C Cacbon 12 |
7 N Nito 14 |
8 O Oxi 16 |
9 F Flo 19 |
10 Ne Neon 20 |
Chu kì 3 gồm 8 nguyên tố:
Số e lớp ngoài cùng của nguyên tử các nguyên tố tăng dần từ 1 đến 8
Tính kim loại giảm dần, đồng thời tính phi kim tăng dần. Đầu chu kì là kim loại mạnh cuối chu kì là phi kim mạnh.
| 3 |
11 Na Natri 23 |
12 Mg Magie 24 |
13 Al Nhôm 27 |
14 Si Silic 28 |
15 P Photpho 31 |
16 S Lưu huỳnh 32 |
17 Cl Clo 35,5 |
18 Ar Agon 40 |
2. Trong một nhóm
Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân. Số lớp electron trong nguyên tử tăng dần, tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
Thí dụ:*) Nhóm I gồm 6 nguyên tố từ Li đến Fr
Số lớp electron tăng dần từ 2 đến 7. Số electron lớp ngoài cùng của nguyên tử đều bằng 1.
Tính kim loại của các nguyên tố tăng dần. Đầu nhóm là kim loại hoạt động mạnh cuối nhóm là kim loại hoạt động rất mạnh
*) Nhóm VII gồm 5 nguyên tố từ F đến At
Số lớp electron tăng dần từ 2 đến 6. Số electron lớp ngoài cùng của nguyên tử đều bằng 7.
Tính phi kim của các nguyên tố giảm dần. Đầu nhóm là phi kim hoạt động mạnh cuối nhóm là phi kim hoạt động hóa học yếu hơn.
IV. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
1. Biết vị trí của nguyên tố ta có thể suy đoán cấu tạo nguyên tử và tính chất của nguyên tố.
Thí dụ: Nguyên tố A có số hiệu nguyên tử là 17, chu kì 3, nhóm VIIA. Hãy cho biết cấu tạo nguyên tử, tính chất nguyên tố A và so sánh với các nguyên tố bên cạnh.
Trả lời: Nguyên tố A có số hiệu nguyên tử là 17, suy ra điện tích hạt nhân của nguyên tử A là 17+, nguyên tử A có 17 electron.
A ở chu kì 3, suy ra nguyên tử A có 3 lớp electron; nhóm VIIA suy ra lớp ngoài cùng có 7e.
Vì ở gần cuối chu kì 3 nên A là một phi kim mạnh, tính phi kim của A yếu hơn của nguyên tố phía trên nó trong cùng nhóm (là F có số hiệu nguyên tử là 9). mạnh hơn của nguyên tố trước nó trong cùng chu kì (là S có số hiệu là 16) và nguyên tố đứng dưới nó trong cùng nhóm (là Br có số hiệu nguyên tử là 35)
Nhận xét: Biết vị trí của nguyên tố trong bảng tuần hoàn có thể suy đoán cấu tạo nguyên tử và tính chất cơ bản của nguyên tố, so sánh tính kim loại hay phi kim của nguyên tố này với những nguyên tố lân cận
2. Biết cấu tạo nguyên tử của nguyên tố có thể suy đoán vị trí và tính chất nguyên tố đó.
Thí dụ: Nguyên tố X có điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron.
Hãy cho biết vị trí của X trong bảng tuần hoàn và tính chất cơ bản của nó.
Trả lời:
Vì nguyên tử X có điện tích hạt nhân là 11+, 3 lớp electron và có 1e ở lớp ngoài cùng, suy ra nguyên tố X ở ô 11, chu kì 3, nhóm IA.
Nguyên tố X là kim loại vì ở đầu chu kì
Nhận xét: Biết cấu tạo nguyên tử của nguyên tố có thể suy đoán vị trí nguyên tố trong bảng tuần hoàn và tính chất hóa học cơ bản của nó
B. Giải bài tập Hóa 9 bài 31
VnDoc đã hướng dẫn giải chi tiết bài tập sách giáo khoa Hóa 9 bài 31 tại: Giải Hóa 9 bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hoá học
C. Trắc nghiệm Hóa học 9 bài 31
Câu 1: Nhóm các nguyên tố được sắp xếp theo chiều tính phi kim tăng dần là
A. O, F, N, C.
B. F, O, N, C.
C. O, N, C, F.
D. C, N, O, F.
Đáp án: D
Câu 2: Trong 1 chu kỳ (trừ chu kì 1), đi từ trái sang phải tính chất của các nguyên tố biến đổi như sau
A. tính kim loại và tính phi kim đều giảm dần.
B. tính kim loại và tính phi kim đều tăng dần.
C. tính kim loại giảm dần đồng thời tính phi kim tăng dần.
D. tính kim loại tăng dần đồng thời tính phi kim giảm dần.
Đáp án: C
Câu 3: Dãy các kim loại nào sau đây được sắp xếp theo chiều tính kim loại tăng dần?
A. K, Na, Li, Rb.
B. Li, K, Rb, Na.
C. Na, Li, Rb, K.
D. Li, Na, K, Rb.
Đáp án: D
Câu 4: Cho các nguyên tố sau O, P, N. Hãy chỉ ra thứ tự sắp xếp đúng theo chiều tính phi kim tăng dần
A. O, P, N.
B. N, P, O.
C. P, N, O.
D. O, N, P.
Đáp án: C
Câu 5: Biết X có cấu tạo nguyên tử như sau: điện tích hạt nhân là 12+, có 3 lớp electron, lớp ngoài cùng có 2 electron. Vị trí của X trong bảng tuần hoàn là
A. chu kỳ 3, nhóm II.
B. chu kỳ 3, nhóm III.
C. chu kỳ 2, nhóm II.
D. chu kỳ 2, nhóm III.
Đáp án: A
Câu 6: Nguyên tử của nguyên tố X có 3 lớp electron, lớp electron ngoài cùng có 7 electron. Vị trí và tính chất cơ bản của nguyên tố X là
A. thuộc chu kỳ 3, nhóm VII là kim loại mạnh.
B. thuộc chu kỳ 7, nhóm III là kim loại yếu.
C. thuộc chu kỳ 3, nhóm VII là phi kim mạnh.
D. thuộc chu kỳ 3, nhóm VII là phi kim yếu.
Đáp án: C
Câu 7: Trong chu kỳ 3, X là nguyên tố đứng đầu chu kỳ, còn Y là nguyên tố đứng cuối chu kỳ nhưng trước khí hiếm. Nguyên tố X và Y có tính chất sau
A. X là kim loại mạnh, Y là phi kim yếu.
B. X là kim loại mạnh, Y là phi kim mạnh.
C. X là kim loại yếu, Y là phi kim mạnh.
D. X là kim loại yếu, Y là phi kim yếu.
Đáp án: B
Câu 8: Nguyên tố M có số hiệu nguyên tử là 19, chu kỳ 4, nhóm I trong bảng tuần hoàn các nguyên tố hóa học. Phát biểu nào sau đây đúng?
A. Điện tích hạt nhân 19+, 4 lớp electron, lớp ngoài cùng có 1 electron, kim loại mạnh.
B. Điện tích hạt nhân 19+, 1 lớp electron, lớp ngoài cùng có 4 electron, kim loại mạnh.
C. Điện tích hạt nhân 19+, 4 lớp electron, lớp ngoài cùng có 4 electron, kim loại yếu.
D. Điện tích hạt nhân 19+, 4 lớp electron, lớp ngoài cùng có 1 electron, kim loại yếu.
Đáp án: A
Câu 9: Nguyên tố X ở chu kỳ 4 nhóm VI, nguyên tố Y ở chu kỳ 2 nhóm VII. So sánh tính chất của X và Y thấy
A. tính phi kim của X mạnh hơn Y.
B. tính phi kim của Y mạnh hơn X.
C. X, Y có tính phi kim tương đương nhau.
D. X, Y có tính kim loại tương đương nhau.
Đáp án: B
Câu 10: Nguyên tố X có hiệu số nguyên tử là 10. Điều khẳng định nào sau đây không đúng?
A. Điện tích hạt nhân của nguyên tử là 10+, nguyên tử có 10 electron.
B. Nguyên tử X cuối chu kỳ 2.
C. X là một khí hiếm.
D. X là 1 kim loại hoạt động yếu.
Đáp án: D
...........................................................
Mời các bạn tham khảo thêm một số tài liệu liên quan
- Các công thức hóa học lớp 9 Đầy đủ nhất
- Chuỗi phản ứng Hóa học vô cơ lớp 9
- Đề cương ôn tập học kì 2 môn Hóa học lớp 9
Ngoài tài liệu Hóa 9 bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học tới các bạn, mời các bạn tham khảo thêm Giải SBT Hóa 9, Trắc nghiệm Hóa học 9, Phương trình phản ứng Hóa học, Lý thuyết Hóa học 9 được cập nhật trên VnDoc để học tốt Hóa 9 hơn.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Luyện thi lớp 9 lên lớp 10. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.







