Hóa học 9 Bài 8: Một số bazơ quan trọng
Hóa học 9 Bài 8: Một số bazơ quan trọng được VnDoc biên soạn, nội dung tóm tắt trọng tâm hóa 9 bài 8, giới thiệu tới các bạn một số oxit bazơ đặc trưng là NaOH và Canxi hiđroxit. Từ đó giúp các bạn vận dụng làm các dạng bài tập dưới dạng câu hỏi trắc nghiệm Hóa học 9.
Một số bazơ quan trọng
Hi vọng rằng đây sẽ là tài liệu hữu ích dành tặng quý thầy cô và các bạn học sinh. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới.
A. Tóm tắt nội dung kiến thức trọng tâm
I. Natri hiđroxit
1. Tính chất vật lí
- Là chất rắn, không màu, hút ẩm mạnh, tan nhiều trong nước, tỏa nhiệt
- Dung dịch NaOH có tính nhờn, làm bục vải giấy, làm mòn da, còn được gọi là dung dịch xút hoặc xút ăn da.
2. Tính chất hóa học
NaOH có những tính chất hóa học của một bazơ tan
a. Làm đổi màu chất chỉ thị
- Đổi màu quỳ tím thành xanh.
- Dung dịch phenolphthalein không màu thành màu hồng.
b. Tác dụng với axit (Tạo thành muối và nước)
NaOH + HCl → NaCl + H2O
c. Tác dụng với oxit axit (tạo thành muối và nước)
2NaOH + CO2 → Na2CO3 + H2O
3. Ứng dụng
Có nhiều ứng dụng rộng rãi trong công nghiệp và đời sống
- Sản xuất xà phòng, chất tẩy rửa, bột giặt
- Sản xuất tơ nhân tạo
- Sản xuất giấy
- Chế biến dầu mỏ
- Dùng nhiều trong ngành công nghiệp hóa chất khác
4. Sản xuất NaOH
Phương pháp: điện phân dung dịch NaCl bão hòa
Thùng điện phân có màng ngăn giữa 2 cực
2NaCl + 2H2O ![]() \(\overset{dpdd}{\rightarrow}\) 2NaOH + H2 + Cl2 (có màng ngăn)
\(\overset{dpdd}{\rightarrow}\) 2NaOH + H2 + Cl2 (có màng ngăn)
II. Canxi hiđroxit - Thang pH
1. Tính chất
a. Cách pha chế dung dịch Ca(OH)2
Có tên gọi thông thường là nước vôi trong.
Để có được nước vôi trong tiến hành hòa tan 1 ít vôi tôi Ca(OH)2 trong nước, ta được nước vôi (hay còn gọi vôi sữa), lọc vôi nước thu được chất lỏng trong suốt, không màu là dung dịch Ca(OH)2. còn được gọi là nước vôi trong.
b. Tính chất hóa học
Ca(OH)2 mang đầy đủ tính chất hóa học của một dung dịch bazơ tan.
- Làm đổi màu chỉ thị: quỳ tím chuyển thành màu đỏ, phenolphtalenin thành màu hồng
- Tác dụng với axit (tạo ra muối và nước)
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
- Tác dụng với oxit axit (tạo ra muối và nước)
Ca(OH)2 + CO2 → CaCO3 + H2O
c. Ứng dụng
- Làm vật liệu trong xây dựng
- Khử chua đất trồng trọt
- Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật,…
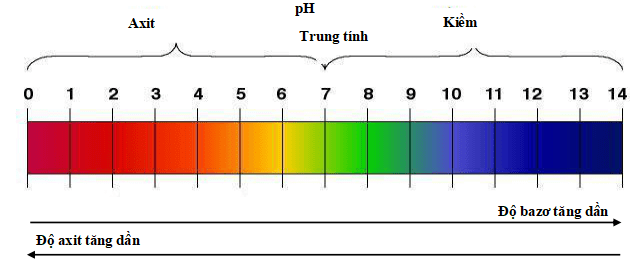
2. Thang pH
Nếu pH = 7 → Dung dịch trung tính (không có tính axit, không có tính bazơ)
Nếu PH < 7 → Dung dịch có tính axit. pH càng nhỏ, độ axit càng lớn.
Nếu pH > 7 → Dung dịch có tính ba zơ. pH càng lớn, độ bazơ càng mạnh.
Mời các bạn tham khảo thêm lý thuyết hóa 9 bài tiếp theo tại: Hóa học 9 Bài 8: Một số bazơ quan trọng
B. Bài tập mở rộng củng cố
Câu 1. Dung dịch có pH > 7 là
A. NaOH
B. CuO
C. HCl
D. KCl
Câu 2. Dung dịch NaOH có thể phản ứng được với dãy chất hóa học nào sau đây
A. HCl, Na2O, CO2
B. CO2, SO2, H2SO4
C. H2SO4, KCl, CO2
D. MgO, SO2, HCl
Câu 3. Dãy hóa chất nào dưới đây đều tác dụng được với dung dịch Ca(OH)2?
A. CO2, HCl, Na2O
B. BaO, HCl, Ca(HCO3)2
C. HCl, BaO, CO2
D. P2O5, HCl, Na2CO3
Câu 4. Cho phản ứng sau:
NaCl + H2O ![]() \(\overset{đpdd}{\rightarrow}\) X + H2 + Cl2 (có màng ngăn)
\(\overset{đpdd}{\rightarrow}\) X + H2 + Cl2 (có màng ngăn)
X là:
A. Na
B. NaOH
C. Na2O
D. NaHCO3
Câu 5. Dãy gồm bazơ tan trong nước là:
A. NaOH, Ca(OH)2, KOH và Cu(OH)2
B. NaOH, Ca(OH)2, Cu(OH)2 và Zn(OH)2
C. NaOH, CaOH)2, Ba(OH)2 và KOH
D. NaOH, KOH, Ca(OH)2 và Ba(OH)2
Câu 6. Dung dịch Ba(OH)2 không có tính chất hóa học nào sau đây
A. Làm quỳ tím chuyển sang màu xanh
B. Tác dụng với axit
C. Bị nhiệt phân
D. Tác dụng với oxit axit
Câu 7. Dung dịch nào dưới đây có pH <7
A. KCl
B. HCl
C. KOH
D. NaCl
Câu 8. Có 3 lọ mất nhãn, mỗi lọ đựng riêng biệt các dung dịch sau: NaCl, NaOH, Ba(OH)2
Thuốc thử để nhận biết các chất trên là:
A. Quỳ tím và dung dịch NaCl
B. Quỳ tím và Na2SO4
C. Quỳ tím và dung dịch HCl
D. Nước và dung dịch KOH
Câu 9. Để trung hòa hoàn toàn dung dịch chứa 8 gam NaOH cần 50 ml dung dịch H2SO4. Nồng độ mol của dung dịch H2SO4 đã dùng là:
A. 1M
B. 0,1M
C. 2M
D. 0,2M
Câu 10. Dẫn 1,12 lít khí CO2 (đktc) và 56 gam dung dịch NaOH 15%. Khối lượng mỗi chất có trong dung dịch thu được sau phản ứng là:
A. 2,8 gam và 7,9 gam
B. 5,6 gam và 6 gam
C. 5,6 gam và 7,9 gam
D. 2,8 gam và 6 gam
Đáp án - Hướng dẫn giải
| 1A | 2B | 3D | 4B | 5D |
| 6C | 7B | 8B | 9C | 10A |
Câu 9.
nNaOH = 840 = 0,2 mol
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,2 → 0,1
![]() \({C_M} = \frac{{{n_{{H_2}S{O_4}(ct)}}}}{{{V_{{H_2}S{O_4}(dd)}}}} = \frac{{0,1}}{{0,05}}. = 2M\)
\({C_M} = \frac{{{n_{{H_2}S{O_4}(ct)}}}}{{{V_{{H_2}S{O_4}(dd)}}}} = \frac{{0,1}}{{0,05}}. = 2M\)
Câu 10.
 \({n_{KOH}} = \frac{{\frac{{C\% .{m_{dd}}}}{{100\% }}}}{{56}} = 0,15 mol\)
\({n_{KOH}} = \frac{{\frac{{C\% .{m_{dd}}}}{{100\% }}}}{{56}} = 0,15 mol\)
nCO2 = 1,12/22,4 = 0,05 mol
Xét tỉ lệ số mol:
=> Sản phẩ là muối K2SO3 và dư KOH.
2KOH + SO2 → K2SO3 + H2O
0,05 0,1 0,05
mK2SO3 = 0,05.158 = 7,9 gam
nKOH phản ứng: nKOH = 2.nSO2 = 2.0,05 = 0,1 mol
nKOH dư = 0,15 - 0,1 = 0,05 mol => mKOH = 0,05.56 = 2,8 (gam)
C. Giải hóa 9 bài 8: Một số bazơ quan trọng
Để hoàn thành tốt các dạng câu hỏi bài tập sách giáo khoa Hóa 9 bài 8 cũng như nắm được lý thuyết nội dung bài học thông qua các câu hỏi bài tập. VnDoc đã biên soạn hướng dẫn giải chi tiết nội dung các câu hỏi để bạn đọc dễ dàng hoàn thành trong quá trình làm bài tập. Mời các bạn tham khảo tại: Giải hóa 9 bài 8: Một số bazơ quan trọng
D. Giải sách bài tập Hóa 9 bài 8 Một số bazo quan trọng
Ngoài các dạng câu hỏi bài tập sách giáo khoa Hóa 9 bài 8. Để rèn luyện nâng cao kĩ năng giải bài tập cũng như các thao tác tính toán nhanh hơn. Các bạn học sinh cần bổ sung làm thêm các câu hỏi sách bài tập. Nội dung bài tập kèm đáp án hướng dẫn giải chi tiết tại: Giải sách bài tập Hóa 9 bài 8 Một số bazo quan trọng
...........
Mời các bạn tham khảo thêm một số tài liệu liên quan:
- Hóa học 9 Bài 9: Tính chất hóa học của muối
- Trắc nghiệm Hóa học 9 bài 8
- Giải bài tập trang 27 SGK Hóa lớp 9: Một số Bazơ quan trọng
- Hóa học 9 Bài 10: Một số muối quan trọng
- Hóa học 9 Bài 11: Phân bón hóa học
Trên đây VnDoc đã đưa tới các bạn bộ tài liệu rất hữu ích Hóa học 9 Bài 8: Một số bazơ quan trọng. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 9, Chuyên đề Vật Lí 9, Lý thuyết Sinh học 9, Giải bài tập Hóa học 9, Tài liệu học tập lớp 9 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Luyện thi lớp 9 lên lớp 10. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








