Tóm tắt lý thuyết Khoa học tự nhiên 9 (Phân môn Hóa học)
Đây là tài liệu Cao cấp - Chỉ dành cho Thành viên VnDoc ProPlus.
- Tải tất cả tài liệu lớp 9 (Trừ Giáo án, bài giảng)
- Trắc nghiệm không giới hạn
Tóm tắt kiến thức hóa học lớp 9
Tóm tắt lý thuyết hóa học 9 được VnDoc biên soạn, tổng hợp kiến thức trọng tâm môn Hóa học lớp 9. Nội dung lý thuyết bao gồm kiến thức các bài học, từ đó đưa ra các dạng câu hỏi trắc nghiệm hóa 9 giúp các bạn ghi nhớ củng cố lại kiến thức. Sau đây mời các bạn tham khảo.
>> Một số nội dung trong chương trình Hóa học mới
- Đọc tên nguyên tố Danh pháp một số hợp chất vô cơ theo IUPAC
- Bảng tuần hoàn các nguyên tố Hóa học lớp 7
- Bảng tuần hoàn Hóa học Tiếng Anh
A. Lý thuyết hóa vô cơ
CHƯƠNG I: Các loại hợp chất vô cơ
1. Tính chất hóa học của oxit
| Oxit axit | Oxit bazơ | |
| Tác dụng với nước |
Một số oxit axit + H2O → dung dịch axit (đổi màu quỳ tím → đỏ) CO2 + H2O → H2CO3 Oxit axit tác dụng được với nước: SO2, SO3, N2O5, P2O5… Không tác dụng với nước: SiO2,… |
Một số oxit bazơ + H2O → dung dịch kiềm (đổi màu quỳ tím → xanh) CaO + H2O → Ca(OH)2 Oxit bazơ tác dụng được với nước: Na2O, K2O, BaO,.. Không tác dụng với nước: FeO, CuO, Fe2O3,… |
| Tác dụng với axit | Không phản ứng |
Acid + Oxit bazơ → muối + H2O FeO + H2SO4 (loãng) → FeSO4 + H2O |
| Tác dụng với bazơ kiềm |
Bazơ + Oxit axit → muối (muối trung hòa, hoặc axit) + H2O CO2 + 2NaOH → Na2CO3 + H2O CO2 + NaOH → NaHCO3 |
Không phản ứng |
| Tác dụng với oxit axit | Không phản ứng |
Oxit axit + Oxit bazơ (tan) → muối CaO + CO2 → CaCO3 |
| Tác dụng với oxit bazơ |
Oxit axit + Oxit bazơ (tan) → muối MgO + SO3 → MgSO4 |
Không phản ứng |
| Oxit lưỡng tính (ZnO, Al2O3, Cr2O3) | Oxit trung tính (oxit không tạo muối) NO, CO,… | |
| Tác dụng với nước | Không phản ứng | Không phản ứng |
| Tác dụng với axit | Al2O3 + 6HCl → 2AlCl3 + 3H2O | Không phản ứng |
| Tác dụng với bazơ | Al2O3 + 2NaOH → 2NaAlO2 + 3H2O | Không phản ứng |
| Phản ứng oxi hóa khử | Không phản ứng |
Tham gia phản ứng oxi hóa khử 2NO + O2 |
2. Tính chất hóa học của axit, bazơ
| Axit | Bazơ | |
| Chất chỉ thị | Đổi màu quỳ tím → đỏ |
đổi màu quỳ tím → xanh Đổi màu dung dịch phenolphatalein từ không màu thành màu hồng |
| Tác dụng với kim loại |
- Axit (HCl và H2SO4 loãng) + kim loại (đứng trước H trong dãy hoạt động hóa học) → muối + H2 Fe + 2HCl → FeCl2 + H2 |
Một số nguyên tố lưỡng tính như Zn, Al, Cr, … 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 |
| Tác dụng với bazơ |
Bazơ + axit → muối + nước NaOH + HCl → NaCl + H2O |
Một số bazơ lưỡng tính (Zn(OH)2, Al(OH)3, …) + dung dịch kiềm Al(OH)3 + NaOH → NaAlO2 + 2H2O |
| Tác dụng với axit |
Bazơ + axit → muối + nước H2SO4 + NaOH → Na2SO4 + H2O
|
|
| Tác dụng với oxit axit | Không phản ứng |
Bazơ + oxit axit → muối axit hoặc muối trung hòa + nước SO2 + NaOH → Na2SO3 + H2O SO2 + NaOH → Na2HSO3 + H2O |
| Tác dụng với oxit bazơ |
Axit +oxit bazơ → muối + nước CaO + H2SO4 → CaSO4 + H2O |
Một số oxit lưỡng tính như ZnO, Al2O3, Cr2O3,… tác dụng với dung dịch bazơ |
| Tác dụng với muối |
Axit + muối → muối mới + axit mới HCl + AgNO3 → AgCl + HNO3 |
Bazơ + muối → Bazơ mới + muối mới KOH + CuSO4 → K2SO4 + Cu(OH)2 |
| Phản ứng nhiệt phân |
Một số axit H2SO4 |
Bazơ không tan Cu(OH)2 |
3. Tính chất hóa học của muối
| Tính chất hóa học | Muối |
| Tác dụng với kim loại |
Kim loại + muối → muối mới + kim loại mới Cu + 2AgNO3 → Cu(NO3)2 + 2Ag Điều kiện: Kim loại đứng trước (trừ Na, K, Ca,…) đẩy kim loại đứng sau (trong dãy hoạt động hóa học) ra khỏi dung dịch muối của chúng. Kim loại Na, K, Ca… khi tác dụng với dung dịch muối thì không cho kim loại mới vì: Na + CuSO4 → 2Na + H2O → NaOH + H2 CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4 |
| Tác dụng với bazơ |
Muối + bazơ → muối mới + bazơ mới FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl |
| Tác dụng với axit |
Muối + axit → muối mới + axit mới BaCl2 + AgNO3 → Ba(NO3)2 + AgCl |
| Tác dụng với muối |
Muối + muối → 2 muối mới BaCl2 + Na2SO4 → BaSO4 + NaCl |
| Nhiệt phân muối |
Một số muối bị nhiệt phân hủy ở nhiệt độ cao CaCO3 2KMnO4 |
CHƯƠNG 2: Kim loại
1. Tính chất của Al và Fe
| Nhôm (Al) | Sắt (Fe) | |
| Tính chất vật lý |
- Là kim loại nhẹ, màu trắng, dẻo, có ánh kim, dẫn điện và dẫn nhiệt tốt. - Nhiệt độ nóng chảy 6600C. |
- Là kim loại nặng, màu trắng xám, dẻo, có ánh kim, dẫn điện, dẫn nhiệt tốt (kém Al). - Nhiệt độ nóng chảy 15390C. - Có tính nhiễm từ. |
| Tính chất hóa học | < Al và Fe có tính chất hóa học của kim loại > | |
| Tác dụng với phi kim |
2Al + 3Cl2 4Al + 3O2 |
2Fe + 3Cl2 2Fe + 3Cl2 |
| Tác dụng với axit | 2Al + 6HCl → 2AlCl3 + 3H2 | Fe + H2SO4 → FeSO4 + H2 |
| Lưu ý: Al và Fe không phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội. | ||
| Tác dụng với dd muối | 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu | Fe + 2AgNO3 ↓ →Fe(NO3)2 + 2Ag |
|
Tính chất khác Tác dụng với dd kiềm |
nhôm + dd kiềm→ H2 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 |
<Không phản ứng> |
| Trong các phản ứng: Al luôn có hóa trị III. | Trong các phản ứng: Fe có hai hóa trị: II, III. | |
| Hợp chất |
Al2O3 có tính lưỡng tính Al2O3 + 6HCl → 2AlCl3 + 3H2O Al2O3 + 2NaOH → 2NaAlO2 + H2O |
FeO, Fe2O3 và Fe3O4 là oxit bazo không tan trong nước. Fe(OH)2 ↓màu trắng Fe(OH)3 ↓màu đỏ nâu |
2. Hợp chất sắt: Gang, thép
| Hợp kim | Gang | Thép |
| Sắt với cacbon (2 – 5%) và một số nguyên tố khác như Si, Mn S. . | Sắt với cacbon (dưới 2%) và các nguyên tố khác như Si, Mn, S . | |
| Tính chất | Giòn (không rèn, không dát mỏng được) và cứng hơn sắt,. | Đàn hồi, dẻo (rèn, dát mỏng, kéo sợi được), cứng. |
| Sản xuất |
Trong lò cao - Nguyên liệu: quặng sắt - Nguyên tắc: CO khử các oxit sắt ở t0 cao. - Các phản ứng chính: Phản ứng tạo thành khí CO: C + O2 C + CO2 CO khử oxit sắt có trong quặng: Fe2O3 + 3CO Fe nóng chảy hoà tan 1 lượng nhỏ |
- Trong lò luyện thép. - Nguyên liệu: gang, khí oxitắc: Oxi hóa các nguyên tố C, Mn, Si, S, P, … có trong gang. - Các phản ứng chính Thổi khí oxi vào lò có gang nóng chảy ở nhiệt độ cao. Khí oxi oxi hoá các nguyên tố kim loại, phi kim để loại khỏi gang phần lớn các nguyên tố C, Si, Mn, S . . . Thí dụ: C + O2 Thu được sản phẩm là thép. |
3. Dãy hoạt động hóa học của kim loại
Theo chiều giảm dần độ hoạt động của kim loại:
Li, K, Ba, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt, Au
Lúc khó bà cần nàng may áo giáp sắt nên sang phố hàng đồng á hiệu phi âu.
Ý nghĩa dãy hoạt động hóa học của kim loại:
- Mức độ họat động hóa học của kim loại giảm dần từ trái qua phải.
- Kim loại đứng trước Mg (5 kim loại đầu tiên) tác dụng với nước ở điều kiện thường à kiềm và khí hiđro.
- Kim loại đứng trước H phản ứng với một số dd axit (HCl, H2SO4 loãng, …) và khí H2.
- Kim loại đứng trước đẩy kim loại đứng sau ra khỏi dung dịch muối (trừ 5 kim loại đầu tiên).
3. Phi kim
| Cl2 | C | |
| Tính chất vật lý | Clo là chất khí màu vàng lục. Rất độc, nặng gấp 2,5 lần không khí |
Có 3 dạng thù hình: kim cương, than chì, cacbon vô định hình. -Có tính hấp phụ |
| Tính chất hóa học | ||
| 1. Tác dụng với hiđro: | Cl2 + H2 → 2HCl | C + 2H2 |
| 2. Tác dụng với kim loại: |
2Fe + 3Cl2 → 2FeCl3 Cu + Cl2 → CuCl2 |
C + Ca |
| 3. Với oxi | Không phản ứng trực tiếp | C + O2 → CO2 |
| 4. Với nước | l2 + H2O ⇔HClO + HCl | C + H2O |
| 5. Với dung dịch kiềm | Cl2 + NaOH → NaClO + NaCl + H2O | Không phản ứng |
| 6. Với dung dịch muối | Cl2 + 2FeCl2 → 2FeCl3 | Không phản ứng |
| 7. Phản ứng oxi hóa khử | Clo thường là chất oxi hóa | CuO + C → CO2 + Cu |
| 8. Phản ứng với hidrocacbon | CH4 + Cl2 →CH3Cl + HCl | Không phản ứng |
| 9. Điều chế |
1. Trong phòng TN 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O 2. Trong công nghiệp 2NaCl + 2H2O → Cl2 + H2 + 2NaOH (điện phân, có màng ngăn) |
|
2. Tính chất của hợp chất cacbon
| Tính chất | Cacbon oxit (CO) | Cacbon đi oxit (CO2) |
| Tính chất vật lí |
CO là khí không màu, không mùi CO là khí rất độc |
CO2 là chất khí không màu, nặng hơn không khí Khí CO2 không duy trì sự sống cháy |
| Tính chất hóa học | ||
| 1. Tác dụng với H2O | Không phản ứng ứng ở nhiệt độ thường | CO2 + H2O ⇔ H2CO3 |
| 2. Tác dụng với dung dịch kiềm | Không phản ứng |
CO2 + 2NaOH → Na2CO3 + H2O CO2 + NaOH → NaHCO3 |
| 3. Tác dụng với hợp chất |
Ở nhiệt độ cao: CO là chất khử 3CO + Fe2O3 → 3CO2 + 2Fe |
CO2 + CaO → CaCO3 |
| 4. Ứng dụng |
Dùng làm nhiên liệu, nguyên liệu chất khử trong công nghiệp hóa học |
Dùng trong sản xuất nước giải khát gas bảo quản thực phẩm, dập tắt đám cháy. |
B. Lý thuyết hóa hữu cơ 9
I. Phân loại hợp chất hữu cơ. Hợp chất hữu cơ gồm 2 loại
+ Hiđrocacbon: Chỉ chứa 2 nguyên tố là H, C.
+ Dẫn xuất của hiđrocacbon: Ngòai 2 nguyên tố H, C còn chứa các nguyên tố khác: N, O, Cl,...
II. Tính chất của hiđrocacbon.
| Metan | Etilen | Axetilen | Benzen | |
| CT cấu tạo | 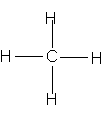 |
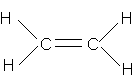 |
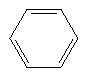 |
|
| T/c vật lý | Chất khí không màu, không mùi,ít tan trong nước | Chất lỏng,không màu,thơm, ít tan trong nước. | ||
| Phản ứng thế |
CH4 + Cl2 CH3Cl + HCl |
Không phản ứng | Sẽ học ở lớp trên |
C6H6 + Cl2 C6H6 + Br2 C6H5Br + HBr |
| P/ứ cộng | Không phản ứng |
C2H4 + H2 C2H4 + Br2 → C2H4Br2 |
C2H2 + H2 C2H4 C2H2 +H2 C2H6 |
C6H6 + 3Cl2 C6H6Cl6 |
| P/ứ trùng hợp | Không phản ứng |
nCH2=CH2 (-CH2-CH2-)n polietilen(PE) |
Sẽ học ở lớp trên |
hông phản ứng |
| P/ứ cháy | CH4 + 2O2 |
C2H4 + 3O2 2CO2 + 2H2O |
2C2H2 + 5O2 4CO2 + 2H2O |
2C6H6 + 15O2 12CO2 + 6H2O |
| P/ứ hợp nước | Không tham gia |
C2H4 + H2O C2H5OH |
Sẽ học ở lớp trên |
Không tham gia |
| Điều chế | CH3COONa + NaOH → CH4 + Na2CO3 |
C2H5OH → C2H4 + H2O |
CaC2 + 2H2O → C2H2 + Ca(OH)2 |
3CHΞ CH → C6H6 |
| Ứng dụng |
Dùng làm nhiên liệu -Sx bột than, H2, CCl4, |
Kích thích quả mau chín, sx rượu, axit ,PE, .. |
Dùng làm nhiên liệu, sx PVC, caosu, … |
Làm dung môi, sx thuốc trừ sâu, chất dẻo,… |
C. Câu hỏi bài tập trắc nghiệm liên quan
I. Câu hỏi trắc nghiệm vô cơ
Bài tập vận dụng
1. Câu hỏi trắc nghiệm khách quan
Câu 1. Dung dịch H2SO4 tác dụng với dãy chất là:
A. Fe, CaO, HCl.
B.Cu, BaO, NaOH.
C. Mg, CuO, HCl.
D. Zn, BaO, NaOH.
Câu 2. Để phân biệt 2 dung dịch HCl và H2SO4. Người ta dùng thuốc thử là:
A. Quỳ tím .
B. Zn.
C. dung dịch NaOH.
D. dung dịch BaCl2.
Câu 3. Chất gây ô nhiễm và mưa acid là
A. Khí O2.
B.Khí SO2.
C. Khí N2.
D. Khí H2.
Câu 4. Cặp chất tạo ra chất kết tủa trắng là
A. CuO và H2SO4.
B. ZnO và HCl.
C. NaOH và HNO3.
D. BaCl2 và H2SO4
Câu 5. Các khí ẩm được làm khô bằng CaO là:
A. H2; O2; N2 .
B. H2; CO2; N2.
C. H2; O2; SO2.
D. CO2; SO2; HCl.
Câu 6. Dãy chất tác dụng được với nước:
A. CuO; CaO; Na2O; CO2
B. BaO; K2O; SO2; CO2 .
C. MgO; Na2O; SO2; CO2.
D. NO; P2O5; K2O; CaO
Câu 7. Chất phản ứng đượcvới dung dịch acid Clohiđric sinh ra chất khí nhẹ hơn không khí, cháy trong không khí với nhọn lửa màu xanh nhạt:
A. BaCO3
B. Zn
C. FeCl3
D. Ag
Câu 8. Oxit axit là :
A. Hợp chất với tất cả kim loại và oxi.
B. Những oxit tác dụng được với axit tạo thành muối và nước .
C. Hợp chất của tất cả các phi kim và oxi .
D. Những oxit tác dụng được với dung dịch bazơ tạo muối và nước.
Câu 9. Chất tác dụng được với HCl và CO2:
A. Sắt
B. Nhôm
C. Kẽm
D. Dung dịch NaOH.
Câu 10. Phương pháp được dùng để điều chế canxi oxit trong công nghiệp.
A. Nung đá vôi ở nhiệt độ cao là trong công nghiệp hoặc lò thủ công .
B. Nung CaSO4 trong lò công nghiệp .
C. Nung đá vôi trên ngọn lửa đèn cồn.
D. Cho canxi tác dụng trực tiếp với oxi.
Câu 11. Phương pháp được dùng để sản xuất khí sunfurơ trong công nghiệp.
A. Phân hủy canxi sunfat ở nhiệt độ cao .
B. Đốt cháy lưu huỳnh trong oxi .
C. Cho đồng tác dụng với axit sunfuric đặc, nóng.
D. Cho muối natrisunfit tác dụng với axit clohiđric.
Câu 12. Chất khi tan trong nước cho dung dịch, làm quỳ tím hóa đỏ :
A. KOH
B. KNO3
C. SO3
D. CaO
Câu 13. Chất tác dụng với axit sunfuric loãng tạo thành muối và nước:
A. Cu
B. CuO
C. CuSO4
D. CO2
Câu 14. Dùng Canxi oxit để làm khô khí:
A. Khí CO2
B. Khí SO2
C. Khí HCl
D. CO
Câu 15. Một hỗn hợp rắn gồm Fe2O3 và CaO, để hòa tan hoàn toàn hỗn hợp này người ta phải dùng dư:
A. Nước.
B. Dung dịch NaOH.
C. Dung dịch HCl.
D. dung dịch NaCl.
Câu 16. Dung dịch axit mạnh không có tính chất là:.
A. Tác dụng với oxit axit tạo thành muối và nước.
B. Tác dụng với bazơ tạo thành muối và nước.
C. Tác dụng với nhiều kim loại giải phóng khí hiđrô.
D. Làm đổi màu quỳ tím thành đỏ.
Câu 17. Đơn chất tác dụng với H2SO4 loãng sinh ra chất khí:
A. Bạc
B. Đồng
C. Sắt
D. Cacbon.
Câu 18. Trong phòng thí nghiệm khí SO2 không thu bằng cách đẩy nước vì SO2 :
A. Nhẹ hơn nước
B. Tan được trong nước.
C. Dễ hóa lỏng
D. Tất cả các ý trên .
Câu 19. Để trung hòa 11,2 gam KOH 20%, thì cần lấy bao nhiêu gam dung dịch axit H2SO4 35%
A. 9 gam
B. 4,6 gam
C. 5,6 gam
D. 1,7 gam
Câu 20. Hòa tan 23,5 gam K2O vào nước. Sau đó dùng 250ml dung dịch HCl để trung hòa dung dịch trên. Tính nồng độ mol HCl cần dùng.
A. 1,5M
B. 2,0 M
C. 2,5 M
D. 3,0 M.
Câu 21. Trong hợp chất của lưu huỳnh hàm lượng lưu huỳnh chiếm 50%. Hợp chất đó có công thức là:
A.SO3
B. H2SO4
C. CuS.
D. SO2.
Câu 22. Đốt hoàn toàn 6,72 gam than trong không khí. Thể tích CO2 thu được ở đktc là :
A. 12,445 lít
B. 125,44 lít
C. 12,544 lít
D. 12,454 lít.
Câu 23: Những oxit tác dụng được với dung dịch bazơ là
A. CaO, CO2, Fe2O3 .
B. K2O, Fe2O3, CaO
C. K2O, SO3, CaO
D. CO2, P2O5, SO2
Câu 24: Khí lưu huỳnh đioxit SO2 được tạo thành từ cặp chất là
A. K2SO4 và HCl.
B. K2SO4 và NaCl.
C. Na2SO4 và CuCl2
D. Na2SO3 và H2SO4
Câu 25. Để nhận biết 2 lọ mất nhãn H2SO4 và Na2SO4, ta sử dụng thuốc thử:
A. HCl
B. Giấy quỳ tím
C. NaOH
D. BaCl2
Câu 26: Dung dịch H2SO4 có thể tác dụng được
A. CO2, Mg, KOH.
B. Mg, Na2O, Fe2(OH)3
C. SO2, Na2SO4, Cu(OH)2
D. Zn, HCl, CuO.
Câu 27: Hòa tan 2,4 gam oxit của kim loại hoá trị II vào 21,9 gam dung dịch HCl 10% thì vừa đủ. Oxit đó là:
A. CuO
B. CaO
C. MgO
D. FeO
Câu 28: Cho dung dịch BaCl2 vào dung dịch H2SO4. Sau phản ứng có hiện tượng kết tủa:
A. Màu xanh
B. Màu đỏ
C. Màu vàng
D.Màu trắng.
Câu 29: Dãy chất gồm toàn oxit bazơ :
A. canxi oxit; lưu huỳnh đioxit; sắt(III)oxit.
B. Kali oxit; magie oxit; sắt từ oxit.
C. Silic oxit; chì(II)oxit; cacbon oxit.
D. Kali oxit; natri oxit; nitơ oxit.
Câu 30: Để loại bỏ khí CO2 có lẫn trong hỗn hợp (O2; CO2). Người ta cho hỗn hợp đi qua dung dịch chứa:
A. HCl
B. Na2SO4
C. NaCl
D. Ca(OH)2.
Câu 31: Các nguyên tố hóa học dưới đây, nguyên tố nào có oxit, oxit này tác dụng với nước, tạo ra dung dịch có pH > 7
A. Mg
B. Cu
C. Na
D. S
Câu 32: Dung dịch của chất X có pH >7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
A. BaCl2
B. NaOH
C. Ba(OH)2
D. H2SO4 .
Câu 33: Nhỏ một giọt quỳ tím vào dung dịch NaOH, dung dịch có màu xanh; nhỏ từ từ dung dịch HCl cho tới dư, vào dung dịch có màu xanh trên thì.
A. Màu xanh vẫn không thay đổi.
B. Màu xanh nhạt dần rồi mất hẳn.
C. Màu xanh nhạt dần rồi mất hẳn, rồi chuyển sanh màu đỏ
D. Màu xanh đậm thêm dần.
Câu 34. Có hai lọ đựng dung dịch bazơ NaOH và Ca(OH)2. Chất dùng để phân biệt hai chất trên:
A. Na2CO3
B. NaCl
C. MgO
D. HCl .
Câu 35: Những cặp chất cũng tồn tại trong một dung dịch.
A. KCl và NaNO3.
B. KOH và HCl
C. Na3PO4và CaCl2
D. HBr và AgNO3.
II. Bài tập trắc nghiệm hóa hữu cơ
Câu 1. Dãy các chất nào sau đây trong phân tử chỉ có liên kết đơn?
A. CH4, C2H6.
B. CH4, C3H6.
C. C2H4, C2H6.
D. C2H4, CH4.
Câu 2. Một hợp chất hữu cơ có công thức C3H7Br , có số công thức cấu tạo là
A. 1
B. 2
C.3
D. 4
Câu 3. Có các công thức cấu tạo sau, công thức biểu diễn mấy chất A
1. CH3 – CH2 – CH2 – CH2 – CH3
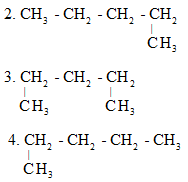
A. 3 chất. B. 2 chất. C. 1 chất. D. 4 chất.
Câu 4. Một hợp chất rượu có công thức C3H7OH. Số công thức cấu tạo của rượu trên là bao nhiêu ?
A. 4
B. 5
C. 3
D. 2
Câu 5. Khi phân tích một hiđrocacbon (X) chứa 85,71% cacbon. Công thức phân tử của (X) là
A. C2H6.
B. C3H6.
C. C2H4.
D. C3H8.
Câu 6. Tính chất vật lí cơ bản của metan là
A. chất lỏng, không màu, tan nhiều trong nước.
B. chất khí, không màu, tan nhiều trong nước.
C. chất khí, không màu, không mùi, nặng hơn không khí, ít tan trong nước.
D. chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
Câu 7. Khi đốt cháy hoàn toàn một thể tích hiđrocacbon X, thu được thể tích khí CO2 bằng thể tích hiđrocacbon X khi đem đốt (trong cùng điều kiện về nhiệt độ và áp suất). Hiđrocacbon đó là
A. C2H2
B. C2H4
C. CH4
D. C3H6
Câu 8. Hợp chất hữu cơ nào sau đây chỉ có phản ứng thế với clo, không có phản ứng cộng với clo ?
A. C3H6
B. C4H8
C. C2H4
D. CH4
Câu 9. Sản phẩm chủ yếu của một hợp chất hữu cơ khi cháy là
A. khí nitơ và hơi nước.
B. khí cacbonic và khí hiđro.
C. khí cacbonic và cacbon.
D. khí cacbonic và hơi nước.
Câu 10. Cho các chất sau: H2O, HCl, Cl2, O2, Br. Khí metan phản ứng được với
A. H2O, HCl
B. Cl2, O2
C. HCl, Cl2
D. O2, Br, HCl
Câu 11. Để loại bỏ khí axetilen trong hỗn hợp với metan người ta dùng
A. khí nito.
B. khí hiđro.
C. dung dịch brom.
D. khí oxi.
Câu 12. Trong phân tử etilen giữa hai nguyên tử cacbon có
A. một liên kết đơn.
B. một liên kết đôi.
C. hai liên kết đôi.
D. một liên kết ba.
Câu 13. Các trái cây, trong quá trình chín sẽ thoát ra một lượng nhỏ chất khí là
A. metan.
B. etan.
C. etilen.
D. axetilen.
Câu 14. Khí CH4 và C2H4 có tính chất hóa học giống nhau là (
A. tham gia phản ứng thế với dung dịch brom.
B. tham gia phản ứng cộng với khí Nito.
C. tham gia phản ứng cộng với dung dịch brom.
D. tham gia phản ứng cháy với khí oxi sinh ra khí cacbonic và nước.
Câu 15. Khí etilen cho phản ứng đặc trưng là
A. phản ứng cháy.
B. phản ứng thế.
C. phản ứng cộng.
D. phản ứng trùng ngưng.
Câu 16. Khí X có tỉ khối so với hiđro là 15. Khí X
A. CH4.
B. C3H8.
C. C2H6.
D. C2H4.
Câu 17. Biết 0,02 mol hiđrocacbon X có thể tác dụng tối đa với 100ml dung dịch brom 0,2M. Vậy X là
A. C2H4.
B. CH4.
C. C2H2.
D. C2H6.
Câu 18. Đốt cháy hoàn toàn 4,48 lít khí etilen ở đktc. Thể tích khí oxi và thể tích không khí cần dùng ở đktc là ( biết rằng khí oxi chiếm 20% thể tích không khí)
A. 13,44 lít; 67,2 lít.
B. 16,8 lít; 84 lít.
C. 6,72 lít; 33,6 lít.
D. 3,36 lít; 16,8 lít.
Câu 19. Đốt cháy hoàn toàn 5,6 gam khí etilen. Thể tích khí oxi cần dùng ở đktc và khối lượng khí CO2 sinh ra là
A. 13,44 lít; 17,6 gam.
B. 6,72 lít; 13,2 gam.
C. 11,2 lít; 22 gam.
D. 5,6 lít; 11 gam.
Câu 20. Dẫn 2,8 lít (ở đktc) hỗn hợp khí metan và etilen đi qua bình đựng dung dịch brom dư thấy có 4 gam brom đã phản ứng. Thành phần phần trăm về thể tích các khí trong hỗn hợp lần lượt là
A. 50 %; 50%.
B. 40 %; 60%.
C. 30 %; 70%.
D. 80 %; 20%.
Câu 21. Đốt cháy hoàn toàn 25 cm3 một hỗn hợp gồm metan và etilen thì cần 60 cm3 oxi ( các khí đo ở đktc). Thành phần phần trăm theo thể tích các khí trong hỗn hợp ban đầu lần lượt là
A. 60%; 40%.
B. 50%; 50%.
C. 40%; 60%.
D. 30%; 70%.
Câu 22. Nhiệt độ sôi của rượu etylic là
A. 78,30C.
B. 7,30C.
C. 73,50C.
D. 73,70C.
Câu 23. Trong 100 ml rượu 550 có chứa
A. 55 ml nước và 45 ml rượu nguyên chất.
B. 55 ml rượu nguyên chất và 45 ml nước.
C. 55 gam rượu nguyên chất và 45 gam nước.
D. 55 gam nước và 45 gam rượu nguyên chất.
Câu 24. Nhóm –OH trong phân tử rượu etylic có tính chất hóa học đặc trưng là
A. tác dụng được với kim loại giải phóng khí hiđro.
B. tác dụng được với natri, kali giải phóng khí hiđro.
C.tác dụng được với magie, bạc giải phóng khí hiđro.
D. tác dụng được với đồng, sắt giải phóng khí hiđro.
Câu 25. Cho 5,6 lít khí etilen ( đktc) tác dụng với nước có axit sunfuric (H2SO4) làm xúc tác, thu được 4,6 gam rượu etylic. Hiệu suất phản ứng là
A. 44,4%.
B. 45,6 %.
C. 66,7%.
D. 55,8 %.
Câu 26. Rượu etylic có khả năng hòa tan trong nước hơn metan, etilen là do
A. trong phân tử rượu etylic có 2 nguyên tử cacbon.
B. trong phân tử rượu etylic có 6 nguyên tử hiđro.
C. trong phân tử rượu etylic có nhóm – OH.
D. trong phân tử rượu etylic có 2 nguyên tử cacbon và 6 nguyên tử hiđro.
Câu 27. Đốt cháy dẫn xuất của hidrocacbon X, chứa 1 nguyên tử oxi theo sơ đồ sau:
X + 3O2 → 2CO2 + 3H2O X là
A. C2H4O.
B. C2H6O.
C. C3H8O.
D. C3H6O.
Câu 28. Hòa tan một mẫu natri dư vào rượu etylic nguyên chất thu được 2,24 lít khí H2 ( đktc). Thể tích rượu etylic đã dùng là (Biết khối lượng riêng của rượu etylic là D= 0,8g/ml)
A. 11,0 ml.
B. 11,5 ml.
C. 12,0 ml.
D. 12,5 ml.
Câu 29. Giấm ăn là dung dịch axit axetic có nồng độ (Chương 5/ bài 45/ mức 1)
A. trên 5%.
B. dưới 2%.
B. từ 2% - 5%.
D. từ 3% - 6%.
Câu 30. Trong công nghiệp một lượng lớn axit axetic được điều chế bằng cách
A. oxi hóa metan có xúc tác và nhiệt độ thích hợp.
B. oxi hóa etilen có xúc tác và nhiệt độ thích hợp.
C. oxi hóa etan có xúc tác và nhiệt độ thích hợp.
D. oxi hóa butan có xúc tác và nhiệt độ thích hợp.
Câu 31. Phản ứng lên men giấm là
A. C2H6O + H2O ![]() CH3COOH + H2O.
CH3COOH + H2O.
B. C2H5OH ![]() CH3COOH + H2O.
CH3COOH + H2O.
C. C2H5OH + O2![]() CH3COOH.
CH3COOH.
D. C2H5OH + O2![]() CH3COOH + H2O.
CH3COOH + H2O.
Câu 32. Cặp chất tồn tại được trong một dung dịch là ( không xảy ra phản ứng hóa học với nhau)
A. CH3COOH và NaOH.
B. CH3COOH và H3PO4.
C. CH3COOH và Ca(OH)2.
D. CH3COOH và Na2CO3.
Câu 33. Cho 100 ml dung dịch CH3COOH 0,1M vào 100 ml dung dịch Ca(OH)20,1M. Dung dịch sau phản ứng có khả năng
A. làm quỳ tím hóa xanh.
B. làm quỳ tím hóa đỏ.
C. không làm quỳ tím đổi màu.
D. tác dụng với Mg giải phóng khí H2.
Câu 34. Cho dung dịch chứa 10 gam CH3COOH tác dụng với dung dịch chứa 10 gam KOH. Sau khi phản ứng hoàn toàn dung dịch chứa các chất tan là
A. CH3COOK và KOH.
B. CH3COOK và CH3COOH.
C. CH3COOK.
D. CH3COOK, CH3COOH và KOH.
Câu 35. Cho axit axetic tác dụng với rượu etylic có mặt H2SO4đặc làm xúc tác và đun nóng. Sau phản ứng thu được 44 gam etyl axetat. Khối lượng CH3COOH và C2H5OH đã phản ứng là
A. 60 gam và 46 gam.
B. 30 gam và 23 gam.
C. 15 gam và 11,5 gam.
D. 45 gam và 34,5 gam.
Câu 36. Hòa tan hoàn toàn 13gam Zn vào dung dịch CH3COOH. Thể tích khí H2 thoát ra (đktc) là
A. 0,56 lít.
B. 4,48lít.
C. 2,24 lít.
D. 3,36 lít.
Câu 37. Cho 30 gam axit axetic CH3COOH tác dụng với rượu etylic dư có mặt H2SO4đặc làm xúc tác (hiệu suất 100%). Khối lượng etyl axetat tạo thành là
A. 33 gam.
B. 44 gam.
C. 55 gam.
D. 66 gam.
Câu 38. Hòa tan 20 gam CaCO3vào dung dịch CH3COOH dư. Thể tích CO2thoát ra ( đktc) là
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 5,60 lít.
Câu 39. Cho dung dịch chứa10 gam hỗn hợp C2H5OH và CH3COOH tác dụng với Zn dư thu được 1,12 lít khí H2(đktc). Thành phần phần trăm theo khối lượng của rượu etylic và axit axetic lần lượt là
A. 30% và 70%.
B. 40% và 60%.
C. 70% và 30%.
D. 60% và 40%.
Câu 40. Chọn câu đúng trong các câu sau
A. Những chất có nhóm –OH và nhóm –COOH tác dụng được với KOH.
B. Những chất có nhóm –OH tác dụng được với K.
C. Những chất có nhóm –COOH tác dụng với KOH nhưng không tác dụng với K.
D. Những chất có nhóm –OH và nhóm –COOH cùng tác dụng với K và KOH.
Mời các bạn tham khảo đầy đủ chi tiết nội dụng ở link TẢI VỀ miễn phí bên dưới
.................................




