Bảng tuần hoàn nguyên tố hóa học
Bảng nguyên tố hóa học
Liên minh Quốc tế về Hóa học Thuần túy và Hóa học Ứng dụng (IUPAC) đã chính thức công bố và đưa bốn nguyên tố mới (113, 115, 117 và 118) vào chu kỳ thứ bảy trong bảng tuần hoàn các nguyên tố hóa học của Mendeleev. Chúng ta sẽ không thể tìm thấy bốn nguyên tố này trong tự nhiên - chúng đều tồn tại dưới dạng tổng hợp trong phòng thí nghiệm. VnDoc.com xin cập nhật tới các bạn bảng tuần hoàn hóa học đầy đủ nhất.
Bảng tuần hoàn nguyên tố hóa học
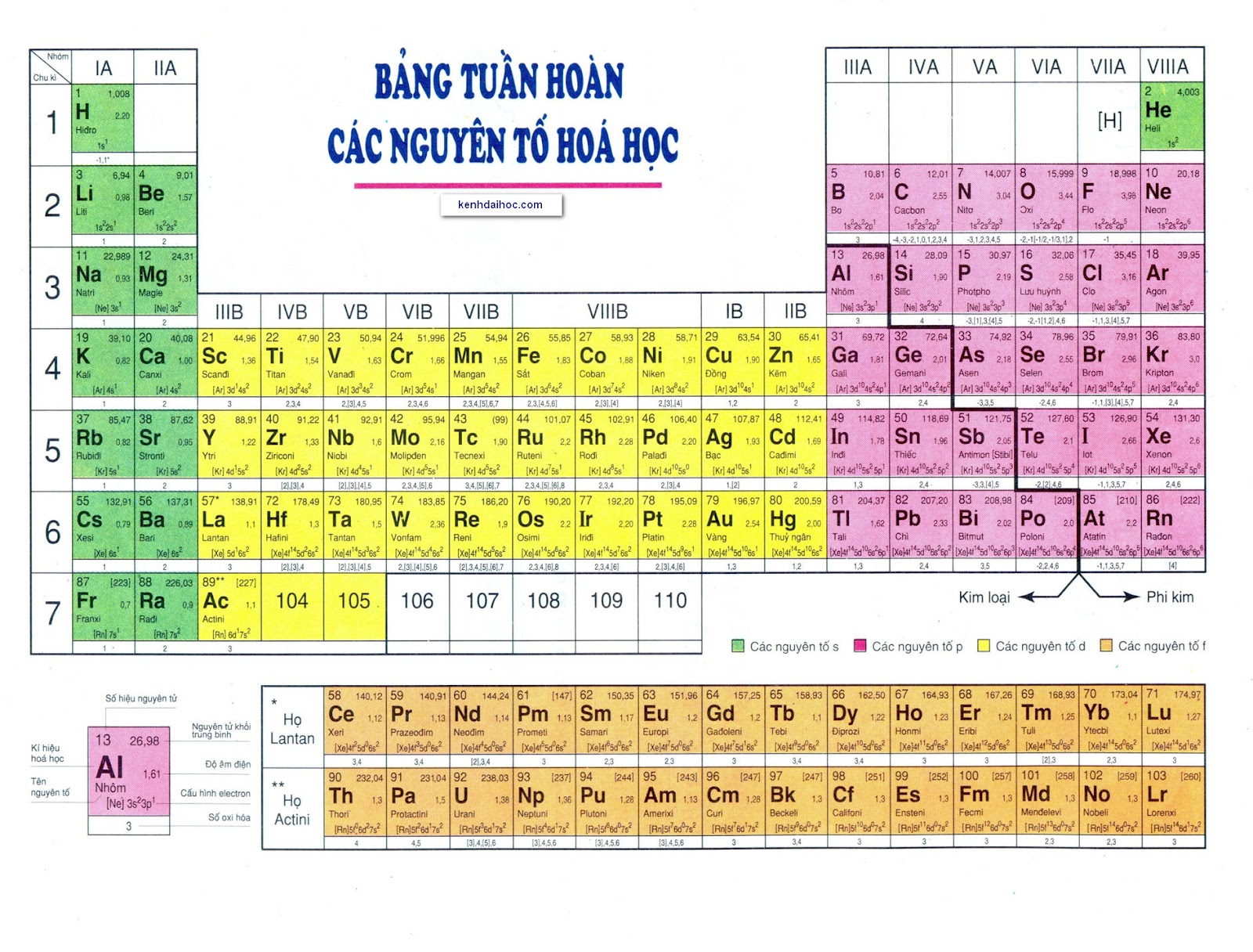
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp xếp thành một hàng (chu kì)
- Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột (nhóm)
II. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
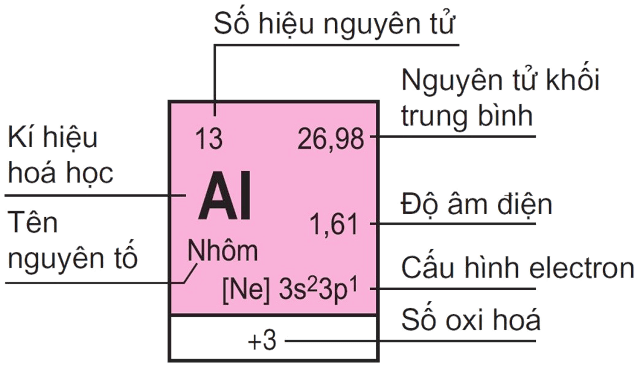
1. Ô nguyên tố
Mỗi nguyên tố hóa học được xếp vào một ô của bảng gọi là ô nguyên tố.
Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
2. Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Chu kì 1: gồm 2 nguyên tố H (Z=1) đến He (Z=2).
Chu kì 2: gồm 8 nguyên tố Li (Z=3) đến Ne (Z=10).
Chu kì 3: gồm 8 nguyên tố Na (Z=11) đến Ar (Z=18).
Chu kì 4: gồm 18 nguyên tố K (Z=19) đến Kr (Z=36).
Chu kì 5: gồm 18 nguyên tố Rb (Z=37) đến Xe (Z=54).
Chu kì 6: gồm 32 nguyên tố Cs (Z=55) đến Rn (Z=86).
Chu kì 7: Bắt đầu từ nguyên tố Fr (Z=87) đến nguyên tố có Z = 110, đây là một chu kì chưa hoàn thành.
Chu kì 1, 2, 3: là các chu kì nhỏ.
Chu kì 4, 5, 6, 7: là các chu kì lớn.
3. Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B
- Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIII)
Nhóm A: bao gồm các nguyên tố s và p.
Nhóm A gồm 8 nhóm từ IA đến VIIIA
Các nguyên tố nhóm A gồm nguyên tố s và nguyên tố p
Số thứ tự nhóm A = tổng số e lớp ngoài cùng
Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng (n-1)dxnsy
Nếu (x+y) = 3 => 7 thì nguyên tố thuộc nhóm (x+y)B.
Nếu (x+y) = 8 => 10 nguyên tố thuộc nhóm VIIIB
Nếu (x+y) > 10 thì nguyên tố thuộc nhóm (x+y-10)B
Các nguyên tố nhóm B là tập hợp các nguyên tố có electron hóa trị nằm trên phân lớp d và f
III. Sự biến đổi tuần hoàn một số tính chất của các nguyên tố
1. Sự biến đổi tính kim loại, tính phi kim
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ mất electron để trở thành ion dương. Nguyên tử càng dễ mất electron thì tính kim loại của nguyên tố càng mạnh.
Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ thu electron để trở thành ion âm. Nguyên tử càng dễ thu electron thì tính phi kim của nguyên tố càng mạnh.
a. Trong cùng chu kỳ, khi điện tích hạt nhân tăng: Tính kim loại giảm, tính phi kim tăng dần.
b. Trong cùng nhóm A, khi điện tích hạt nhân tăng: Tính kim loại tăng, tính phi kim giảm dần.
2. Sự biến đổi một số đại lượng vật lý
a. Sự biến đổi bán kính nguyên tử khi điện tích hạt nhân tăng:
+ Trong cùng chu kỳ : bán kính giảm.
+ Trong cùng nhóm A: bán kính tăng.
b. Sự biến đổi năng lượng ion hóa thứ nhất của các nguyên tố nhóm A: Khi điện tích hạt nhân tăng:
+ Trong cùng chu kỳ năng lượng ion hóa tăng.
+ Trong cùng nhóm, năng lượng ion hóa giảm.
Năng lượng ion hóa thứ nhất (I1) của nguyên tử là năng lượng tối thiểu cần để tách electron thứ nhất ra khỏi nguyên tử ở trạng thái cơ bản. (tính bằng Kj/mol)
3. Sự biến đổi độ âm điện
Độ âm điện: của một nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học
Theo chiều tăng dần của điện tích hạt nhân:
+ Trong cùng chu kỳ, độ âm điện tăng.
+ Trong cùng nhóm, độ âm điện giảm.
4. Sự biến đổi hóa trị
Trong cùng chu kỳ, khi điện tích hạt nhân tăng, hóa trị cao nhất với oxi tăng từ 1 đến 7, hóa trị đối với hidro giảm từ 4 đến 1.
Hóa trị đối với hidro= số thứ tự nhóm –hóa trị đối với oxi
Công thức phân tử ứng với các nhóm nguyên tố (R: là nguyên tố)
R2On: n là số thứ tự của nhóm.
RH8-n: n là số thứ tự của nhóm.
5. Sự biến đổi tính axit – bazo của oxit và hidroxit tương ứng
a. Trong cùng chu kỳ , khi điện tích hạt nhân tăng: tính bazo giảm, tính axit tăng.
b. Trong cùng nhóm A, khi điện tích hạt nhân tăng: tính bazo tăng, tính axit giảm.
IV. Cách thuộc bảng tuần hoàn nguyên tố hóa học
Chu kỳ I: H He → hoa héo
Chu kì 2: Li Be B C N O E Ne → Li bể bà cằn nhằn ông phải nể
Chu kỳ 3: Na Mg Al Si P S Cl Ar → Nàng mang áo sang phố sửa choanh.
* Nhóm IA ( trừ hiđrô )
Li (lính)
Na (nào)
K (không)
Rb (rượu)
Cs (cà)
Fr (phê)
* Nhóm IIA
Be (bé)
Mg (mang)
Ca (cá)
Sr (sang)
Ba (bà)
Ra (rán)
* Nhóm IIIA
B (Ba)
Al (anh lấy)
Ga (gà)
In (in tiếng anh ngĩa là tr0ng)
Tl (tủ lạnh)
* Nhóm IVA
C (Cô)
Si (sinh)
Ge (gọi em)
Sn (sang nhậu)
Pb (phở bò)
* Nhóm VA
N (Nicô)
P (phàm tục)
As (ắt)
Sb (sầu)
Bi (bi)
* Nhóm VIA
O (Ông)
S (Say)
Se (xỉn)
Te (té)
Po (bò)
* Nhóm VIIA
F (Phải)
C (Chi)
Br (bé)
I (Iu)
At (anh)
* Nhóm VIIIA
He (hằng)
Ne (nga)
Ar (ăn)
Kr (khúc)
Xe (xương)
Rn (rồng)
V. Câu hỏi vận dụng liên quan
Câu 1. Các nguyên tố nhóm a trong bảng tuần hoàn là
A. các nguyên tố s.
B. các nguyên tố p.
C. các nguyên tố s và nguyên tố p.
D. các nguyên tố d.
Câu 2. Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc nào?
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
C. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành 1 cột.
D. Cả A, B, C.
Câu 3. Nguyên tố X (Z=34). Vị trí của X là
A. Ô 34, chu kỳ 4, nhóm VIA.
B. Ô 34, chu kỳ 4, nhóm VIB
C. Ô 34, chu kỳ 4, nhóm VA.
D. Ô 34, chu kỳ 4, nhóm VB.
Câu 4. Tính kim loại giảm dần trong dãy :
A. Al, B, Mg, C
B. Mg, Al, B, C
C. B, Mg, Al, C
D. Mg, B, Al, C
Câu 5. Dãy kim loại xếp theo tính kim loại tăng dần là:
A. Al, Mg, Ca, Rb, K
B. Mg, Ca, Al, K, Rb
C. Al, Mg, Ca, K, Rb
D. Ca, Mg, Al, Rb, K
Câu 6. X và Y là hai nguyên tố thuộc nhóm A, trong cùng một chu kì của bảng tuần hoàn. Biết Y có nhiều hơn X là 5 electron p, số electron s của X và Y bằng nhau. Phát biểu nào sau đây đúng?
A. X có thể là kim loại kiềm.
B. Giữa vị trí của X và Y trong bảng tuần hoàn luôn có 4 nguyên tố.
C. Y có thể thuộc nhóm VA.
D. X không thể là nguyên tố p.
..............................
Trên đây VnDoc đã giới thiệu Bảng tuần hoàn nguyên tố hóa học tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.











