Giải Hóa 9 bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hoá học
Mời các bạn tham khảo Giải Hóa 9 bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hoá học được VnDoc đăng tải sau đây. Tài liệu hướng dẫn giải các bài tập trong SGK Hóa 9 trang 103 giúp các bạn củng cố và nâng cao kiến thức được học, luyện giải Hóa 9 hiệu quả. Mời các bạn tham khảo tài liệu dưới đây chuẩn bị cho bài học sắp tới.
Giải Hóa 9 bài 32: Luyện tập chương 3
A. Tóm tắt Lý thuyết hóa 9 bài 32
1. Tính chất hóa học của phi kim
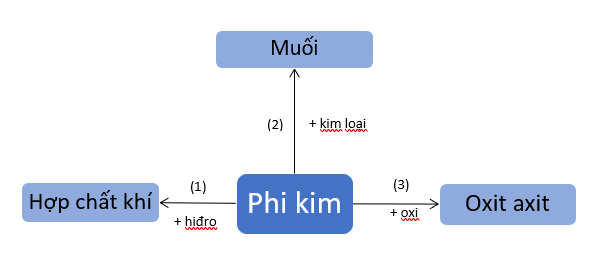
2. Tính chất hóa học của clo
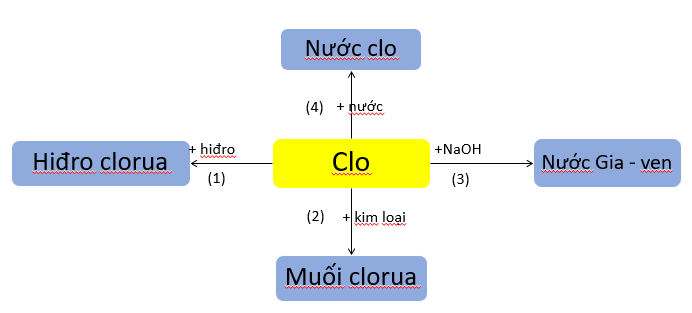
3. Tính chất hóa học các hợp chất của cacbon
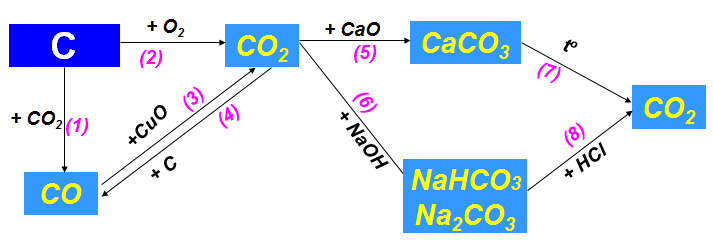
Tính chất hóa học CO
a) CO là oxit trung tính: ở điều kiện thường không phản ứng với nước, kiềm và axit.
b) CO là chất khử: ở nhiệt độ cao CO khử được nhiều oxit kim loại ở nhiệt độ cao và cháy trong oxi
Phương trình hóa học (điều kiện nhiêt độ)
CO + CuO (màu đen) → CO2 + Cu (màu đỏ)
CO cháy trong oxi, ngọn lửa màu xanh, tỏa nhiều nhiệt
Phương trình hóa học:
2CO + O2 → 2CO2
Cacbon đioxit (CO2)
1. Tính chất vật lí
CO2 là chất khí, không màu, không mùi, nặng hơn không khí , không duy trì sự sống và sự cháy.
Nước đá khô (tuyết cacbonic) là CO2 bị nén và làm lạnh thì hóa rắn dùng bảo quản thực phẩm.
2. Tính chất hóa học: CO2 là một oxit axit.
a) Tác dụng với nước → axit cacbonic:
Phương trình hóa học:
CO2 + H2O ⇌ H2CO3
b) Tác dụng với dd bazơ tan → muối + nước:
Phương trình hóa học:
CO2 + 2NaOH → Na2CO3 + H2O
c) Tác dụng với oxit bazơ tan → muối:
Phương trình hóa học:
CO2 + CaO → CaCO3
Kết luận: CO2 có những tính chất của oxit axit.
4. Bảng tuần hoàn các nguyên tố hóa học
a) Cấu tạo của bảng tuần hoàn
- Ô nguyên tố
- Chu kỳ
- Nhóm
b) Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
- Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
- Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân:
Số lớp electron của nguyên tử tăng dần.
Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
B. Giải bài tập Hóa 9 bài 32: Luyện tập chương 3
Bài 1 trang 103 sgk Hóa 9
Căn cứ vào sơ đồ 1, hãy viết các phương trình hoá học với phi kim cụ thể là lưu huỳnh.
Đáp án hướng dẫn giải chi tiết
S + H2 ![]() H2S
H2S
S + 2Na ![]() Na2S
Na2S
S + O2 ![]() SO2
SO2
Bài 2 trang 103 sgk Hóa 9
Hãy viết các phương trình hoá học biểu diễn tính chất hoá học của clo theo sơ đồ 2.
Đáp án hướng dẫn giải chi tiết
(1) H2 + Cl2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2HCl
\(\overset{t^{\circ } }{\rightarrow}\) 2HCl
(2) 2Fe + 3Cl2 → 2FeCl3
(3) Cl2 + 2NaOH → NaCl + NaClO + H2O
(4) Cl2 (k) + H2O (l) → HCl (dd) + HClO (dd)
Bài 3 trang 103 sgk Hóa 9
Hãy viết các phương trình hoá học biểu diễn tính chất hoá học của cacbon và một số hợp chất của nó theo sơ đồ 3. Cho biết vai trò của cacbon trong các phản ứng đó.
Đáp án hướng dẫn giải chi tiết
(1) C + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO↑
\(\overset{t^{\circ } }{\rightarrow}\) CO↑
(2) C + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CO2↑
\(\overset{t^{\circ } }{\rightarrow}\) CO2↑
(3) 2CO + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CO2↑
\(\overset{t^{\circ } }{\rightarrow}\) 2CO2↑
(4) CO2 + C ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CO2↑
\(\overset{t^{\circ } }{\rightarrow}\) 2CO2↑
(5) CO2 + CaO → CaCO3
(6) CO2 + 2NaOH → Na2CO3 + H2O
(7) CaCO3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CaO + CO2↑
\(\overset{t^{\circ } }{\rightarrow}\) CaO + CO2↑
(8) Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Bài 4 trang 103 sgk Hóa 9
Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng tuần hoàn các nguyên tố hoá học. Hãy cho biết:
- Cấu tạo nguyên tử của A.
- Tính chất hoá học đặc trưng của A.
- So sánh tính chất hoá học của A với các nguyên tố lân cận.
Đáp án hướng dẫn giải chi tiết
- Số hiệu là 11
- Cấu tạo nguyên tử: Na
- Tính chất hóa học đặc trưng là kim loại hoạt động mạnh
- Tính chất hóa học của A mạnh hơn Mg, Al
Bài 5 trang 103 sgk Hóa 9
a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32 gam oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4 gam chất rắn. Biết khối lượng mol phân tử của oxit sắt là 160 gam/mol.
b) Chất khí sinh ra được hấp thụ hoàn toàn bằng nước vôi trong dư. Tính khối lượng kết tủa thu được.
Đáp án hướng dẫn giải chi tiết
a) Gọi CTHH của oxit sắt là: FexOy
Phương trình hóa học
FexOy + yCO → xFe + yCO2
Số mol Fe là
nFe = 22,4/56 = 0,4mol
Theo PTHH ta có:
Số mol FexOy là 0,4/x
Suy ra: (56x + 16y).(0,4/x) = 32
=> x : y = 2 : 3
Từ khối lượng mol là 160 ta suy ra công thức phân tử của oxit sắt Fe2O3
b. Phương trình hóa học
CO2 + Ca(OH)2 → CaCO3 + H2O
Số mol CO2 = (0,4 x 3)/2 = 0,6mol
Suy ra số mol CaCO3 là: 0,6mol
Khối lượng của CaCO3 là: mCaCO3 = 0,6 x 100 = 60gam
Bài 6 trang 103 sgk Hóa 9
Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dần khí X vào 500 ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Đáp án hướng dẫn giải chi tiết
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
nMnO2 = nCl2 = 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
nNaOH pư = 0,5.2 = 1,6 mol
nNaOH bđ = 0,5.4 = 2 mol
nNaOH dư = 2 - 1,6 = 0,4 mol
CMNaCl = 0,8/0,5 = 1,6M
CMNaClO = 0,8/0,5 = 1,6M
CMNaOH = 0,4/0,5 = 0,8 M
>> Mời các bạn tham khảo thêm giải bài tập Hóa 9 bài tiếp theo tại: Giải Hóa 9 Bài 33: Thực hành Tính chất hóa học của phi kim và hợp chất của chúng
C. Giải bài tập SBT Hóa 9 bài 32: Luyện tập chương 3
Để giúp các bạn học sinh được luyện tập, củng cố nhiều các dạng bài tập. VnDoc đã hướng dẫn biên soạn hướng dẫn giải chi tiết đầy đủ các dạng bài tập sách bài tập tại: Giải Sách bài tập Hóa học 9 bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
D. Trắc nghiệm Hóa 9 bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hoá học
Ngoài luyện giải Hóa 9 bài 32, VnDoc gửi tới các bạn bộ câu hỏi trắc nghiệm Hóa 9 giúp các bạn nắm vững kiến thức được học. Tài liệu dưới dạng trực tuyến cho các em trực tiếp làm bài và kiểm tra kết quả ngay khi làm xong.
Câu 1. Chỉ ra cặp chất tác dụng được với dung dịch NaOH.
A. CO, SO2
B. SO2, SO3
C. FeO, Fe2O3
D. NO, NO2
Câu 2. Chất khí nào sau đây có thể gây chết người vì ngăn cản sự vận chuyển oxi trong máu?
A. CO
B. CO2
C. SO2
D. NO
Câu 3. Phản ứng giữa Cl2 và dung dịch NaOH dùng để điều chế
A. thuốc tím.
B. nước javen.
C. clorua vôi.
D. kali clorat.
Câu 4. Trong thực tế, người ta có thể dùng cacbon để khử oxit kim loại nào trong số các oxit kim loại dưới đây để sản xuất kim loại?
A. Al2O3
B. Na2O
C. MgO
D. Fe3O4
Câu 5. Khi dẫn khí clo vào dung dịch quì tím xảy ra hiện tượng
A. dung dịch quì tím hóa đỏ.
B. dung dịch quì tím hóa xanh.
C. dung dịch quì tím không chuyển màu.
D. dung dịch quì tím hóa đỏ sau đó mất màu ngay.
Câu 6. Trong các chất sau chất nào có thể tham gia phản ứng với clo?
A. Oxi.
B. Dung dịch NaOH.
C. CuO.
D. NaCl.
>> Mời các bạn tham khảo chi tiết nội dung tài liệu liên quan: Trắc nghiệm Hóa học lớp 9 bài 32
.............................................
Trên đây, VnDoc đã gửi tới các bạn Giải Hóa 9 bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hoá học. Để xem lời giải những bài tiếp theo, mời các bạn vào chuyên mục Giải Hóa 9 trên VnDoc nhé. Chuyên mục tổng hợp lời giải theo từng đơn vị bài học, giúp các em củng cố kiến thức được học hiệu quả.
Ngoài ra, mời các bạn tham khảo các Trắc nghiệm Hóa học 9, Giải sách bài tập Hóa 9, Giải bài tập Hóa học 9 giúp các bạn rèn luyện thêm kỹ năng giải đề và làm bài tốt hơn. Chúc các bạn học tốt
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Luyện thi lớp 9 lên lớp 10. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








