Hóa học 9 Bài 12: Mối quan hệ giữa các hợp chất vô cơ
Hóa học 9 Bài 12: Mối quan hệ giữa các hợp chất vô cơ hướng dẫn trả lời các câu hỏi trong SGK Hóa 9 bài 12. Nội dung tài liệu xâu chuỗi mối quan hệ giữa các hợp chất vô cơ, giúp các bạn học sinh dễ dàng ghi nhớ tính chất hóa học, thấy được mối liên quan giữa các hợp chất vô cơ, từ đó vận dụng giải các dạng bài tập Hóa học 9 dễ dàng hơn. Sau đây mời các bạn tham khảo chi tiết.
Mối quan hệ giữa các hợp chất vô cơ
Hy vọng với tài liệu Hóa 9 Bài 12 này sẽ giúp các bạn học sinh học tốt hơn cũng như quý thầy cô trong quá trình soạn giảng của mình. Mời các bạn tham khảo.
I. Tóm tắt nội dung lý thuyết Hóa 9 bài 12
1. Các hợp chất vô cơ
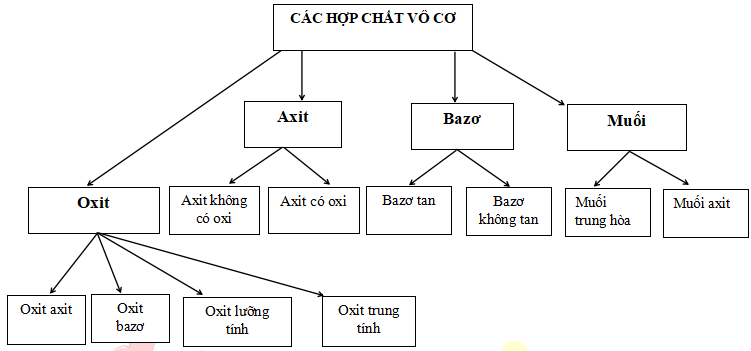
2. Mối quan hệ giữa các hợp chất vô cơ
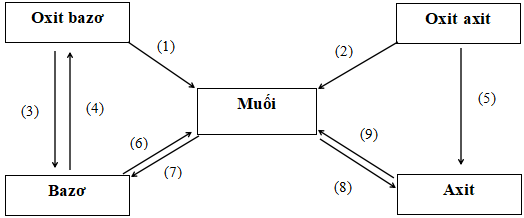
II. Những phản ứng hóa học minh họa
(1) CuO + 2HCl → CuCl2 + H2
(2) CO2 + KOH → K2CO3 + H2O
(3) K2O + H2O → 2KOH
(4) Cu(OH)2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) CuO + H2O
\(\overset{t^{\circ } }{\rightarrow}\) CuO + H2O
(5) SO2 + H2O → H2SO3
(6) Mg(OH)2 + H2SO4 → MgSO4 + H2O
(7) CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
(8) AgNO3 + HCl → AgCl + HNO3
(9) H2SO4 + ZnO → ZnSO4 + H2O
III. Bài tập củng cố mở rộng.
Phần 1. Câu hỏi trắc nghiệm
Câu 1. NaOH không được tạo thành trong thí nghiệm nào sau đây?
A. Cho kim loại Na tác dụng với H2O
B. Cho oxit kim loại Na2O tác dụng với H2O
C. Cho Na2O tác dụng với dung dịch HCl
D. Cho Na2SO4 tác dụng với Ba(OH)2
Câu 2. Cho các chất: SO2, NaOH, MgCO3, CaO và HCl. Số cặp chất phản ứng được với nhau là:
A. 2
B. 4
C. 3
D. 5
Câu 3. Thí nghiệm nào dưới đây không tạo ra muối
A. Cho bột CuO tác dụng với dung dịch HCl
B. Cho Fe tác dụng với dung dịch HCl
C. Cho muối NaCl tác dụng với AgNO3
D. Cho Ag tác dụng với H2SO4 loãng
Câu 4. Để phân biệt 3 chất rắn MgO, AgCl và CaCO3 có thể dùng thuốc thử là
A. Dung dịch NaOH
B. nước
C. Dung dịch Ca(OH)2
D. Dung dịch HCl
Câu 5. Cho hỗn hợp sau: NaCl, Na2CO3 và NaOH. Để thu được muối ăn tinh khiết, từ hỗn hợp trên có thể dùng một lượng dư dung dịch chất nào sau đây?
A. BaCl2
B. HCl
C. Na2CO3
D. CaCl2
Câu 6. Dãy chất nào dưới đây không phản ứng được với H2SO4 loãng
A. NaHCO3, KCl, BaCl2, CO2
B. CuCl2, NaOH, Na2CO3, CaO
C. Na2CO3, BaCl2, BaO, NaOH
D. SO2, CuO, KOH, BaCl2
Câu 7. Cặp chất nào không thể tồn tại trong cùng một dung dịch
A. BaCl2 và K2CO3
B. AgNO3 và NaNO3
C. Ba(NO3)2 và Ca(OH)2
D. KCl và Ca(OH)2
Câu 8. Dung dịch muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất:
A. CO2, KOH, H2SO4, Zn
B. H2SO4, AgNO3, Ba(OH)2, Al
C. KOH, BaCl2, Zn, H2SO4
D. KOH, BaCl2, Zn, Al
Câu 9. Trong các dung dịch sau, chất nào phản ứng được với dung dịch CaCl2?
A. AgNO3
B. HCl
C. HNO3
D. KNO3
Câu 10. Sản phẩm thu được khi điện phân dung dịch NaCl bão hòa trong bình điện phân có màng ngăn là
A. NaClO, Cl2 và H2
B. NaOH, NaCl và Cl2
C. NaOH, Cl2 và H2
D. NaClO, NaCl
Câu 11. Ngâm một đinh sắt sạch trong dung dịch đồng (II) sunfat có màu xanh. Hiện tượng xảy ra là:
A. Chỉ có màu xanh của dung dịch ban đầu nhạt dần.
B. Chỉ một phần đinh sắt bị hoà tan.
C. Kim loại đồng màu đỏ bám ngoài đinh sắt, đinh sắt không bị hoà tan.
D. Một phần đinh sắt bị hoà tan, kim loại đồng màu đỏ bám ngoài đinh sắt, màu xanh của dung dịch ban đầu nhạt dần.
Câu 12. Khí CO thường được dùng làm chất đốt trong công nghiệp. Một loại khí CO có lẫn tạp chất CO2, SO2. Hoá chất rẻ tiền nào sau đây có thể loại bỏ những tạp chất trên ra khỏi CO?
A. H 2 O cất.
B. dung dịch HCl.
C. dung dịch nước vôi trong
D . dung dịch xút.
Phần 2. Câu hỏi tự luận
Câu 1. Viết các phương trình hóa học theo sơ đồ chuyển hóa sau:
a) Na → Na2O → NaOH → Na2CO3 → NaCl → NaOH → NaHCO3
b) Al → AlCl3 → Al(NO3)3 → Al(OH)3 → Al2O3 → Al
Câu 2. Hãy ghép thí nghiệm ghi ở cột (I) với hiện tượng ghi ở cột (II) cho phù hợp.
| Thí nghiệm (I) | Hiện tượng (II) |
| A. Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3 | (1) Chất rắn màu trắng tạo thành, dung dịch thu được không màu |
| B. Cho dây Al vào ống nghiệm đựng dung dịch CuSO4. | (2) Chất rắn màu nâu đỏ tạo thành, dung dịch thu được không màu |
| C. Cho dung dịch BaCl2 vào ống nghiệm đựng dung dịch Na2SO4. | (3) Chất rắn màu đỏ tạo thành bám vào thanh kim loại, màu xanh của dung dịch nhạt dần |
| D. Cho dung dịch HCl vào ống nghiệm đựng Cu(OH)2 | (4) Chất rắn màu nâu đỏ tạo thành, dung dịch thu được màu trắng |
| (5) Chất rắn tan dần, dung dịch tạo thành màu xanh |
Câu 3. Cho 5 dung dịch riêng biệt: K2SO4, AgNO3, NaOH, Ba(OH)2, HCl. Chỉ dùng quỳ tím, trình bày các bước nhận biết 5 dung dịch trên. Viết các phương trình phản ứng xảy ra.
Câu 4. Biết 12 gam muối hỗn hợp 2 muối CaCO3 và CaSO4 tác dụng vừa đủ với 400ml dung dịch HCl thu được 0,672 lít khí (ở đktc)
a) Tính nồng độ mol dung dịch HCl đã dùng
b) Tính thành phần % theo khối lượng mỗi muối có trong hỗn hợp ban đầu.
Câu 5. Từ 160 tấn quặng pirit sắt FeS2 (chứa 40% lưu huỳnh) người ta sản xuất được 147 tấn axit sunfuric. Tính hiệu suất quá trình sản xuất axit sunfuric.
IV. Đáp án - Hướng dẫn giải
1. Phần câu hỏi trắc nghiệm
| Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 |
| C | D | D | D | B |
| Câu 6 | Câu 7 | Câu 8 | Câu 9 | Câu 10 |
| C | A | D | A | C |
Câu 8.
Dung dịch CuSO4 phản ứng được với: KOH, BaCl2, Zn, Al
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
CuSO4 + BaCl2 → CuCl2 + BaSO4 ↓
CuSO4 + Zn → ZnSO4 + Cu
3CuSO4 + 2Al → Al2(SO4)3 + 3Cu
Câu 9.
Điều kiện để muối phản ứng được với dd axit hay muối khác là: sản phẩm tạo thành có chất kết tủa hoặc bay hơi; hoặc axit tạo thành yếu hơn axit tham gia phản ứng.
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl↓
2. Phần câu hỏi tự luận
Câu 1.
a) Na → Na2O → NaOH → Na2CO3 → NaCl → NaOH
1) 4Na + O2 → 2Na2O
2) Na2O + H2O → NaOH
3) 2NaOH + CO2 → Na2CO3 + H2O
4) Na2CO3 + HCl → NaCl + CO2 + H2O
5) 2NaCl + H2O → 2NaOH + H2 + Cl2
b) Al → AlCl3 → Al(NO3)3 → Al(OH)3 → Al2O3 → Al
1) 2Al + 3Cl2 → 3AlCl3
2) AlCl3 + 3AgNO3 → Al(NO3)3 + 3AgCl
3) Al(NO3)3 + 3NaOH → Al(OH)3 + 3NaNO3
4) 2Al(OH)3 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Al2O3 + 3H2O
\(\overset{t^{\circ } }{\rightarrow}\) Al2O3 + 3H2O
Câu 2.
A - 2; B - 3; C - 1; D- 5
Câu 3.
Trích mẫu thử và đánh số thứ tự
Bước 1: Nhúng giấy quỳ tím vào 5 dung dịch trên
Dung dịch không làm đổi màu quỳ tím là K2SO4 và AgNO3
Dung dịch làm đổi màu quỳ tím thành xanh là: NaOH và Ba(OH)2
Bước 2: Nhỏ dung dịch HCl vừa nhận biết được vào 2 dung dịch không làm quỳ đổi màu
Dung dịch không xảy ra phản ứng là K2SO4
Xuất hiện kết tủa trắng là AgNO3
AgNO3 + HCl → AgCl↓ + HNO3
Bước 3: Nhỏ dung dịch K2SO4 vào 2 dung dịch làm quỳ tím hóa xanh
Dung dịch phản ứng tạo kết tủa trắng là Ba(OH)2
Dung dịch không xảy ra phản ứng là NaOH
K2SO4 + Ba(OH)2 → BaSO4 ↓ + 2KOH
Câu 4.
Ở đây ta nhận thấy CaCO3 phản ứng được với HCl còn CaSO4 không phản ứng được với HCl
nCO2 = 0,03 mol
Phương trình phản ứng hóa học:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
nHCl phản ứng = 2nCO2 = 2. 0,03 = 0,06 mol
c) nCaCO3 = nCO2 = 0,03 mol
 \(\begin{array}{l}
\% {m_{CaC{O_3}}} = \frac{{{m_{CaC{O_3}}}}}{{{m_{hh}}}}.100\% = \frac{{0,03.100}}{{12}}.100\% = 25\% \\
= > \% {m_{CaS{O_4}}} = 100\% - 30\% = 75\%
\end{array}\)
\(\begin{array}{l}
\% {m_{CaC{O_3}}} = \frac{{{m_{CaC{O_3}}}}}{{{m_{hh}}}}.100\% = \frac{{0,03.100}}{{12}}.100\% = 25\% \\
= > \% {m_{CaS{O_4}}} = 100\% - 30\% = 75\%
\end{array}\)
Câu 5.
Khối lượng FeS2 có trong 80 tấn quặng FeS2 là:
![]() \(\frac{{160.40\% }}{{100\% }} = 64\) (tấn)
\(\frac{{160.40\% }}{{100\% }} = 64\) (tấn)
Sơ đồ quá trình sản xuất H2SO4 từ quặng pirit sắt:
S → SO2 → SO3 → H2SO4
Theo PTPƯ: 32 98 gam
64 tấn → ![]() \(\frac{{64.98}}{{32}} = 196\) (tấn)
\(\frac{{64.98}}{{32}} = 196\) (tấn)
Nhưng thực tế chỉ thu được 147 tấn H2SO4
Hiệu suất quá trình sản xuất H2SO4:
![]() \(H = \frac{{147}}{{196}}.100\% = 75\%\)
\(H = \frac{{147}}{{196}}.100\% = 75\%\)
V. Giải bài tập hóa học 9 bài 12 Mối quan hệ giữa các hợp chất vô cơ
Giúp các bạn học sinh hoàn thành tốt các bài tập sgk hóa học 9 bài 12 Mối quan hệ giữa các hợp chất vô cơ, VnDoc đã biên soạn hướng dẫn giải các bài tâp SGK một cách chi tiết dễ hiểu nhất để gửi tại bạn đọc tại:
.............................
Mời các bạn tham khảo thêm một số tài liệu liên quan:
- Bảng hệ thống hóa các loại hợp chất vô cơ
- Giải bài tập trang 41 SGK Hóa lớp 9: Mối quan hệ giữa các loại chất vô cơ
Ngoài Hóa học 9 Bài 12: Mối quan hệ giữa các hợp chất vô cơ, mời các bạn tham khảo thêm Hóa 9, Giải SBT Hóa 9, Trắc nghiệm Hóa học 9 trên VnDoc để học tốt môn Hóa hơn.









