Đề thi thử vào lớp 10 Chuyên Hóa học năm 2020
Đề thi vào 10 lớp Hóa trường Chuyên có gợi ý đáp án
Đề thi thử vào lớp 10 Chuyên Hóa học năm 2020 có đáp án, được VnDoc biên soạn nội dung câu hỏi dành tặng cho các bạn thi vào trường Chuyên Hóa lớp 10, nội dung câu hỏi là toàn bộ chương trình Hóa học cấp 2 đi sâu vào từng dạng bài tập khó.
Hy vọng, đề thi này sẽ giúp các bạn luyện tập và làm quen với cấu trúc thi đề thi vào lớp 10 môn Hóa trường Chuyên.
|
ĐỀ THI THỬ Đề số 1 |
KÌ THI TUYỂN SINH VÀO LỚP 10 CHUYÊN THPTNĂM 2020 MÔN THI: HÓA HỌC Thời gian làm bài: 150 phút |
Bản quyền thuộc về VnDoc nghiêm cấm mọi hành vi sao chép vì mục đích thương mại
Câu I (1,5 điểm)
(1) Hoàn thành và xác định các chất có trong sơ đồ sau:
KClO3 ![]() \(\overset{t^{\circ } } {\rightarrow}\) A + B
\(\overset{t^{\circ } } {\rightarrow}\) A + B
A + KMnO4 + H2SO4 → C + ? + ? + ?
A điện phân nóng chảy → D + C
D + H2O → E + ?
C + E ![]() \(\overset{t^{\circ } }{\rightarrow}\) ? + ?
\(\overset{t^{\circ } }{\rightarrow}\) ? + ?
C + E → ? + ?
(2) Hãy xác định tên 5 lọ mất nhãn A, B, C, D, E, mỗi lọ chứa 1 trong 5 dung dịch sau: HgCl2, KI, Pb(NO3)2, HCl và (NH4)2CO3
- Chất A tạo được kết tủa với B nhưng lại tan trong C.
- Chất C tạo khí với E và tạo kết tủa với D.
- Chất E tạo kết tủa với D nhưng không phản với B.
- B không tạo kết tủa với C.
Câu II (3 điểm)
(1) Cho 2g hỗn hợp Fe và kim loại hóa trị II và dung dịch HCl dư thì thu được 1,12 lít H2 (đktc). Măt khác, nếu hòa tan 4,8g kim loại hóa trị II đó cần chưa đến 500ml dung dịch HCl. Xác định kim loại hóa trị II.
(2) Hòa tan 17,88 một gam hỗn hợp X gồm 2 kim loại kiềm A, B và một kim loại kiềm thổ M vào nước dư thu được 1 dung dịch C và 5,376 lít hidro. Trộn lẫn dung dịch H2SO4 vào dung dịch HCl được dung dịch D có số phân tử gam HCl nhiều gấp 4 lần số phân tử gam H2SO4.
Để trung hòa 1/2 dung dịch C cần hết V lít dung dịch D. Hỏi sau khi cô cạn thu được bao nhiêu gam muối khan 1/2 dung dịch C thì thu được dung dịch E, và 1 lượng hidro bằng 3/4 lượng hidro thu được khi hòa tan X vào nước lúc đầu. Tính m? Biết M dễ tan nhưng MSO4 khó tan.
Câu III (2 điểm)
(1) Khi đưa 675g dung dịch KNO3 bão hòa ở 21oC lên 80oC thì phải thêm bao nhiêu gam KNO3. Biết độ tan của KNO3 ở 21oC là 35 và ở 80oC là 190g.
(2) Cho m rượu etylic vào nước để thu được 250ml dung dich X. Cho 250ml dung dịch X tác dụng với K dư thu được 170,24 ml H2 (đktc). Tính độ rượu, nồng độ mol/l của rượu. Biết drượu etylic = 0,8g/ml, dnước = 1g/ml.
Câu IV (2 điểm)
(1) Không dùng hóa chất nào khác, hãy nhận biết các chất đựng trong lọ mất nhãn sau: KOH, HCl, FeCl3, Pb(NO3)2, Al(NO3)3, NH4Cl.
(2) Tách hỗn gồm BaCO3, BaSO4, KCl, MgCl2 bằng phương pháp hóa học.
Câu V (2,5 điểm)
(1) Cho một hợp chất hữu cơ X chứa C, H, O. Khi đốt cháy hoàn toàn cần dùng ít nhất 2,016 lít O2 (đktc), thu được CO2 và hơi nước với thể tích như nhau ở cùng điều kiện nhiệt độ và áp suất. Hãy xác định công thức phân tử X biết rằng X làm đỏ quỳ tím, tác dụng với CaCO3, giải phóng ra khí CO2.
(2) Cho hỗn A gồm C2H4, C2H2. Lấy 2,96g hỗn hợp A đem đốt cháy hoàn toàn thu được m1 gam CO2 và m2 gam H2O. Lấy 0,616 lít A (dktc) cho tác dụng với lượng dư nước Brom, thấy có 6,8g Br2 đã tham gia phản ứng (phản ứng xảy ra hoàn toàn).
a) Viết phương trình hóa học xảy ra
b) Tính % theo khối lượng và theo thể tích mỗi hidrocacbon trong A.
c) Tính m1, m2?
Cho: H = 1, C = 12, O = 16, N= 14, Cl = 35,5, Fe = 56, S = 32, K = 39, Mn = 55, Al = 27
Gơi ý đáp án đề thi thử vào 10 chuyên Hóa
Câu I
(1)
A: KCl
B: O2
C: Cl2
D: K
E: KOH
(2)
A: HgCl2
B: KI
C: HCl
D: Pb(NO3)2
E: (NH4)2CO3
Câu II
(1) Kim loại cần tìm là Mg
Câu III
(1)
+ Ở 21oC ta có:
Cứ 100g H2O hòa tan tối đa 35 gam KNO3 để tạo thành 135g dung dịch
Theo đề ta có: mdd = 675g
=>![]() \({m_{{H_2}O}} = \frac{{675 \times 100}}{{135}} = 500(g)\)
\({m_{{H_2}O}} = \frac{{675 \times 100}}{{135}} = 500(g)\)
+ Ở 80oC ta có:
Cứ 100g H2O hòa tan tối đa 190 gam KNO3 để tạo thành 290 g dung dịch
Khối lượng nước không đổi
=> Để dung dịch bão hòa ở 80oC thì cần 900g KNO3
Khối lượng KNO3 ở 21oC là 128g vậy cần thêm: 900-175=725g
(2)
Ta có: Độ rượu = ( Vrượu nguyên chất : Vdd rượu) x 100
K + C2H5OH → C2H5OK + 1/2H2
x x x/2
K + H2O → KOH + 1/2H2
y y y/2
 \(\begin{array}{l}
{n_{{H_2}O}} = y\\
{n_{{H_2}}} = \frac{{170,24}}{{22,4}} = 7,6mol = > \frac{x}{2} + \frac{y}{2} = 7,6mol\\
{n_{{C_2}{H_5}OH}} = x = 3,2mol = > {m_{{C_2}{H_5}OH}} = 3,2x46 = 147,2gam\\
{V_{ancol(nc)}} = \frac{m}{d} = \frac{{147,2}}{{0,8}} = 184ml\\
{V_{dd}} = 184 + 250 = 434ml\\
= > D = \frac{{184}}{{434}} \times 100 = {42^o}\\
{C_M} = \frac{n}{V} = \frac{{3,2}}{{0,434}} = 7,3M
\end{array}\)
\(\begin{array}{l}
{n_{{H_2}O}} = y\\
{n_{{H_2}}} = \frac{{170,24}}{{22,4}} = 7,6mol = > \frac{x}{2} + \frac{y}{2} = 7,6mol\\
{n_{{C_2}{H_5}OH}} = x = 3,2mol = > {m_{{C_2}{H_5}OH}} = 3,2x46 = 147,2gam\\
{V_{ancol(nc)}} = \frac{m}{d} = \frac{{147,2}}{{0,8}} = 184ml\\
{V_{dd}} = 184 + 250 = 434ml\\
= > D = \frac{{184}}{{434}} \times 100 = {42^o}\\
{C_M} = \frac{n}{V} = \frac{{3,2}}{{0,434}} = 7,3M
\end{array}\)
Câu IV.
(1)
Cho lần lượt các mẫu thử tác dụng với nhau: 3 chất tạo kết tủa đó là (FeCl3, Pb(NO3)2, Al(NO3)2) và 1 khí có mùi khai NH4Cl) => NaOH (viết phương trình hóa học)
Cho KOH đã nhận biết 5 dung dịch còn lại.
+ Tạo kết tủa nâu đỏ => FeCl3 (Viết phương trình hóa học)
+ Tạo kết tủa đen => Pb(NO3)2
+ Tạo kết tủa keo trắng => Al(NO3)2
Có khí mùi khai thoát ra là NH4Cl
Chất không có hiện tượng gì là => HCl
(2)
Cho nước vào hỗn hợp, lọc lấy kết tủa và thu dung dịch nước lọc
- Kết tủa: BaCO3, BaSO4
Dung dịch: KCl, MgCl2
- Cho hỗn hợp kết tủa + HCl dư => dd BaCl và BaSO4 không tan, lọc lấy dung dịch nước lọc và kết tủa (làm khô) => thu được BaSO4 tinh khiết
- Dung dịch BaCl2 tác dụng với Na2CO3 dư thu được BaCO3 tinh khiết
- Nhóm tan cho tác dụng với NaOH vừa đủ thu Mg(OH)2 kết tủa và dung dịch KCl cô cạn dung dịch KCl thu KCl tinh khiết.
Câu V
(1)
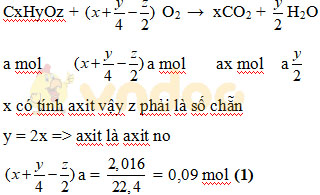

z phải là 1 số chẵn
| z | 2 | 4 | 6 |
| x | 2 | 4 | 6 |
Khi z = 2: C2H4O2 => CH3-COOH
Khi z = 4 => C4H8O4 loại vì hóa trị C
Khi z = 6
(2)
nhhA = 0,275 mol
nBrom = 0,0425 mol
C2H4 + Br2→ C2H4Br2
x x x
C2H2 + 2Br2→ C2H4Br2
y 2y y
Lập hệ phương trình thì ta tìm được kết quả
x= 0,0125 mol => Khối lương C2H4: 0,35g
y= 0,015 mol => Khối lượng C2H2: 0,39g
Tổng khối lượng = 0,74g
Số mol C2H4 và C2H2 trong 2,96 g hỗn hợp là
 \(\begin{array}{l}
{n_{{C_2}{H_4}}} = \frac{{2,96}}{{0,74}} \times 0,0125 = 0,05mol\\
{n_{{C_2}{H_2}}} = \frac{{2,96}}{{0,74}} \times 0,015 = 0,06mol\\
\end{array}\)
\(\begin{array}{l}
{n_{{C_2}{H_4}}} = \frac{{2,96}}{{0,74}} \times 0,0125 = 0,05mol\\
{n_{{C_2}{H_2}}} = \frac{{2,96}}{{0,74}} \times 0,015 = 0,06mol\\
\end{array}\)
 \(\begin{array}{l}
\\
{\% _{{C_2}{H_4}}}^{}theoV = {n_{{C_2}{H_4}}} = \frac{{0,05}}{{0,11}} \times 100\% = 45,5\% \\
\end{array}\)
\(\begin{array}{l}
\\
{\% _{{C_2}{H_4}}}^{}theoV = {n_{{C_2}{H_4}}} = \frac{{0,05}}{{0,11}} \times 100\% = 45,5\% \\
\end{array}\)
%C2H2 = 100% - 45,45% = 54,55%
Tính C% theo m tương tự
c) Tính m1= 9,68g, m2 = 2,7g
VnDoc đã giới thiệu Đề thi thử vào lớp 10 Chuyên Hóa học năm 2020 có đáp án và gợi ý đáp án, với nội dung 5 câu hỏi lớn đi sâu vào từng dạng bài tập, sẽ là tài liệu tham khảo dành cho các bạn học sinh đang chuẩn bị bước vào kỳ thi, tuyển sinh lớp 10 Chuyên Hóa học năm 2020.
Thông qua tài liệu này sẽ giúp các bạn định hướng ôn luyện, làm quen với cấu trúc đề thi và nâng cao kỹ năng giải đề thi.
Trên đây VnDoc đã gửi Đề thi thử vào lớp 10 Chuyên Hóa học năm 2020 tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 9, Chuyên đề Vật Lí 9, Lí thuyết Sinh học 9, Chuyên đề Hóa học. Tài liệu học tập lớp 9 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Luyện thi lớp 9 lên lớp 10. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.



