Hóa 9 bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Hóa 9 bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Hóa học lớp 9 bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học được VnDoc sưu tầm và đăng tải, tổng hợp lý thuyết cơ bản môn Hóa học lớp 9 bài 31, giúp các em nắm vững kiến thức được học trong bài và vận dụng vào giải Hóa học 9 hiệu quả. Mời các bạn tham khảo chi tiết sau đây.
A. Lý thuyết Hóa 9 bài 31
I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
Bảng hệ thống tuần hoàn có hơn 100 nguyên tố được sắp xếp theo chiều tăng dần của số điện tích hạt nhân nguyên tử.
II. CẤU TẠO BẢNG TUẦN HOÀN
1) Ô nguyên tố
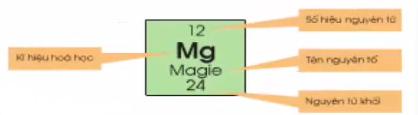
- Bảng tuần hoàn có khoảng 110 ô, mỗi một nguyên tố được sắp xếp vào một ô gọi là ô nguyên tố.
- Ô nguyên tố cho biết: số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố
- Số hiệu nguyên tử là số thứ tự của nguyên tố trong bảng hệ thống tuần hoàn. Số hiệu nguyên tử có trị số bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử.
Ví dụ: Ô thứ 11, xếp nguyên tố natri (Na).
Ta có:
+ Số hiệu nguyên tử = số proton = số electron = 11
+ Kí hiệu hóa học: Na
+ Tên nguyên tố: natri
+ Nguyên tử khối: 23
2) Chu kì
- Chu kì là dãy các nguyên tố được sắp xếp theo hàng ngang
- Trong bảng tuần hoàn các nguyên tố gồm 7 chu kì. Trong đó 3 chu kì nhỏ (chu kì 1, 2, 3) và 4 chu kì lớn (chu kì 4, 5, 6, 7).
- Chu kì gồm các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp thành hàng theo chiều tăng dần điện tích hạt nhân.
- Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của các nguyên tố nằm trong chu kì.
Ví dụ: chu kì 3: bắt đầu là kim loại kiềm Na và kết thúc là khí trơ: Ar (agon)
3) Nhóm
- Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau và do đó có tính chất tương tự nhau, được xếp thành cột theo chiều tăng của điện tích hạt nhân nguyên tử.
III. SỰ BIẾN ĐỔI TÍNH CHẤT CỦA NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
1) Trong một chu kì
- Khi đi từ đầu chu kì đến cuối chu kì theo chiều tăng dần điện tích hạt nhân, ta có:
+ Số electron ngoài cùng của nguyên tử tăng dần từ 1 đến 8 (trừ chu kì 1)
+ Tính kim loại của nguyên tố giảm dần, tính phi kim tăng dần.
=> Như vậy đầu chu kì là kim loại mạnh (kim loại kiềm), cuối chu kì là phi kim mạnh (halogen: flo, clo..), kết thúc chu kì là khí hiếm.
Ví dụ: chu kì 3: đầu chu kì là kim loại kiềm Na (kim loại mạnh) cuối chu kì là phi kim mạnh clo, kết thúc chu kì là khí hiếm agon (Ar)
2) Trong một nhóm
- Khi đi từ trên xuống theo chiều tăng điện tích hạt nhân, ta có:
+ Số lớp electron của nguyên tử tăng dần
+ Tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
IV. Ý NGHĨA CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. Biết vị trí của nguyên tử suy ra cấu tạo nguyên tử và tính chất của nguyên tố.
2. Biết cấu tạo nguyên tử suy ra vị trí và tính chất của nguyên tố.
B. Giải bài tập Hóa 9 bài 31
Ngoài lý thuyết môn Hóa lớp 9 bài 31, mời các bạn tham khảo thêm Giải Hóa 9 bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hoá học để biết cách giải các bài tập trong SGK Hóa 9.
C. Trắc nghiệm Hóa 9 bài 31
Câu 1: Nhóm các nguyên tố được sắp xếp theo chiều tính phi kim tăng dần là
A. O, F, N, C.
B. F, O, N, C.
C. O, N, C, F.
D. C, N, O, F.
Đáp án: D
Các nguyên tố C, N, O, F cùng thuộc chu kỳ 2;
Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân tính phi kim của các nguyên tố tăng dần
→ Tính phi kim: C < N < O < F.
Câu 2: Trong 1 chu kỳ (trừ chu kì 1), đi từ trái sang phải tính chất của các nguyên tố biến đổi như sau
A. tính kim loại và tính phi kim đều giảm dần.
B. tính kim loại và tính phi kim đều tăng dần.
C. tính kim loại giảm dần đồng thời tính phi kim tăng dần.
D. tính kim loại tăng dần đồng thời tính phi kim giảm dần.
Đáp án: C
Câu 3: Dãy các kim loại nào sau đây được sắp xếp theo chiều tính kim loại tăng dần?
A. K, Na, Li, Rb.
B. Li, K, Rb, Na.
C. Na, Li, Rb, K.
D. Li, Na, K, Rb.
Đáp án: D
Các kim loại Li, Na, K, Rb thuộc cùng nhóm IA trong bảng tuần hoàn.
Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân tính kim loại của các nguyên tố tăng dần
→ Tính kim loại: Li < Na < K < Rb.
Câu 4: Cho các nguyên tố sau O, P, N. Hãy chỉ ra thứ tự sắp xếp đúng theo chiều tính phi kim tăng dần
A. O, P, N.
B. N, P, O.
C. P, N, O.
D. O, N, P.
Đáp án: C
Ta có: P và N cùng thuộc nhóm VA, theo quy luật biến đổi xác định được tính phi kim của P < N.
O và N cùng thuộc chu kỳ 2, theo quy luật biến đổi xác định được tính phi kim của N < O.
Chiều tăng dần tính phi kim là: P < N < O.
Câu 5: Biết X có cấu tạo nguyên tử như sau: điện tích hạt nhân là 12+, có 3 lớp electron, lớp ngoài cùng có 2 electron. Vị trí của X trong bảng tuần hoàn là
A. chu kỳ 3, nhóm II.
B. chu kỳ 3, nhóm III.
C. chu kỳ 2, nhóm II.
D. chu kỳ 2, nhóm III.
Đáp án: A
X có 3 lớp electron → X thuộc chu kỳ 3
Lớp ngoài cùng của X có 2 electron → X thuộc nhóm II.
Câu 6: Nguyên tử của nguyên tố X có 3 lớp electron, lớp electron ngoài cùng có 7 electron. Vị trí và tính chất cơ bản của nguyên tố X là
A. thuộc chu kỳ 3, nhóm VII là kim loại mạnh.
B. thuộc chu kỳ 7, nhóm III là kim loại yếu.
C. thuộc chu kỳ 3, nhóm VII là phi kim mạnh.
D. thuộc chu kỳ 3, nhóm VII là phi kim yếu.
Đáp án: C
X có 3 lớp electron → X thuộc chu kỳ 3
Lớp ngoài cùng của X có 7 electron → X thuộc nhóm VII.
X ở phía cuối chu kỳ nên là phi kim mạnh.
Câu 7: Trong chu kỳ 3, X là nguyên tố đứng đầu chu kỳ, còn Y là nguyên tố đứng cuối chu kỳ nhưng trước khí hiếm. Nguyên tố X và Y có tính chất sau
A. X là kim loại mạnh, Y là phi kim yếu.
B. X là kim loại mạnh, Y là phi kim mạnh.
C. X là kim loại yếu, Y là phi kim mạnh.
D. X là kim loại yếu, Y là phi kim yếu.
Đáp án: B
Câu 8: Nguyên tố M có số hiệu nguyên tử là 19, chu kỳ 4, nhóm I trong bảng tuần hoàn các nguyên tố hóa học. Phát biểu nào sau đây đúng?
A. Điện tích hạt nhân 19+, 4 lớp electron, lớp ngoài cùng có 1 electron, kim loại mạnh.
B. Điện tích hạt nhân 19+, 1 lớp electron, lớp ngoài cùng có 4 electron, kim loại mạnh.
C. Điện tích hạt nhân 19+, 4 lớp electron, lớp ngoài cùng có 4 electron, kim loại yếu.
D. Điện tích hạt nhân 19+, 4 lớp electron, lớp ngoài cùng có 1 electron, kim loại yếu.
Đáp án: A
M có số hiệu nguyên tử là 19 nên điện tích hạt nhân nguyên tử M là 19+.
M thuộc chu kỳ 4 nên có 4 lớp electron trong nguyên tử; M thuộc nhóm I nên lớp ngoài cùng có 1 electron.
M đứng ở đầu chu kỳ nên là kim loại mạnh.
Câu 9: Nguyên tố X ở chu kỳ 4 nhóm VI, nguyên tố Y ở chu kỳ 2 nhóm VII. So sánh tính chất của X và Y thấy
A. tính phi kim của X mạnh hơn Y.
B. tính phi kim của Y mạnh hơn X.
C. X, Y có tính phi kim tương đương nhau.
D. X, Y có tính kim loại tương đương nhau.
Đáp án: B
Theo quy luật biến đổi tính chất các nguyên tố trong bảng tuần hoàn xác định được Y là phi kim mạnh nhất. Do đó, tính phi kim của Y mạnh hơn X.
Câu 10: Nguyên tố X có hiệu số nguyên tử là 10. Điều khẳng định nào sau đây không đúng?
A. Điện tích hạt nhân của nguyên tử là 10+, nguyên tử có 10 electron.
B. Nguyên tử X cuối chu kỳ 2.
C. X là một khí hiếm.
D. X là 1 kim loại hoạt động yếu.
Đáp án: D
............................................
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 9 bài 31, mời các bạn tham khảo thêm tài liệu: Hóa học lớp 9, Giải bài tập Hóa học 9, Giải sách bài tập Hóa 9, Tài liệu học tập lớp 9, ngoài ra các bạn học sinh có thể tham khảo thêm đề học kì 1 lớp 9 và đề thi học kì 2 lớp 9 mới nhất được cập nhật.








