Hoá 9 bài 18: Nhôm
Lý thuyết Hóa học lớp 9 bài 18: Nhôm tổng hợp phần lý thuyết cơ bản môn Hoá 9 giúp các em nắm vững kiến thức trong bài, vận dụng trả lời câu hỏi liên quan dễ dàng hơn. Sau đây mời các bạn tham khảo chi tiết.
Lý thuyết Hóa học lớp 9 bài 18: Nhôm
A. Lý thuyết Hóa học lớp 9 bài 18
I. TÍNH CHẤT VẬT LÝ
- Nhôm là kim loại nhẹ (D = 2,7 g/cm3), màu trắng bạc, có ánh kim, nóng chảy ở 6600C
- Nhôm có tính dẫn điện, dẫn nhiệt tốt
- Nhôm có tính dẻo nên có thể cán mỏng được
II. TÍNH CHẤT HÓA HỌC
1) Nhôm phản ứng với phi kim
a) Phản ứng của nhôm với oxi
4Al + 3O2 ![]() \(\xrightarrow{{{t}^{o}}}\) 2Al2O3
\(\xrightarrow{{{t}^{o}}}\) 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước.
b) Phản ứng với phi kim khác
2Al + 3Cl2 ![]() \(\xrightarrow{{{t}^{o}}}\) 2AlCl3
\(\xrightarrow{{{t}^{o}}}\) 2AlCl3
2Al + 3S ![]() \(\xrightarrow{{{t}^{o}}}\) Al2S3
\(\xrightarrow{{{t}^{o}}}\) Al2S3
2) Tác dụng với nước
- Vật bằng nhôm không tác dụng với nước kể cả khi đun nóng vì có lớp màng Al2O3 không cho nước thấm qua
- Nếu phá bỏ lớp Al2O3 thì Al tác dụng với nước
2Al + 6H2O → Al(OH)3 + 3H2
3) Nhôm phản ứng với dung dịch axit
- Nhôm phản ứng với dung dịch axit HCl và H2SO4 loãng tạo thành muối nhôm và giải phóng hiđro
2Al + 6HCl → 2AlCl3 + 3H2
- Nhôm phản ứng với dung dịch axit H2SO4 đặc, nóng và HNO3 đặc, nóng
8Al + 30HNO3đặc ![]() \(\xrightarrow{{{t}^{o}}}\) 8Al(NO3)3 + 3N2O + 15H2O
\(\xrightarrow{{{t}^{o}}}\) 8Al(NO3)3 + 3N2O + 15H2O
8Al + 15H2SO4 đặc ![]() \(\xrightarrow{{{t}^{o}}}\) 4Al2(SO4)3 + 3H2S + 12H2O
\(\xrightarrow{{{t}^{o}}}\) 4Al2(SO4)3 + 3H2S + 12H2O
*Chú ý: Nhôm không tác dụng với H2SO4 đặc, nguội và HNO3 đặc, nguội
4) Nhôm phản ứng với dung dịch muối
Nhôm phản ứng với dung dịch muối của kim loại kém hoạt động hơn tạo thành muối nhôm và giải phóng kim loại trong muối
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
5) Nhôm phản ứng với dung dịch kiềm
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
6) Tác dụng với một số oxit kim loại ở nhiệt độ cao (phản ứng nhiệt nhôm)
Nhôm khử được các oxit kim loại đứng sau Al trong dãy hoạt động hóa học
2Al + Fe2O3 ![]() \(\xrightarrow{{{t}^{o}}}\) 2Fe + Al2O3
\(\xrightarrow{{{t}^{o}}}\) 2Fe + Al2O3
2Al + 3CuO ![]() \(\xrightarrow{{{t}^{o}}}\) 3Cu + Al2O3
\(\xrightarrow{{{t}^{o}}}\) 3Cu + Al2O3
III. ỨNG DỤNG
- Chế tạo đồ dùng gia đình, dây dẫn điện, vật liệu xây dựng
- Chế tạo hợp kim Đuyra dùng trong công nghiệp chế tạo máy bay, ô tô
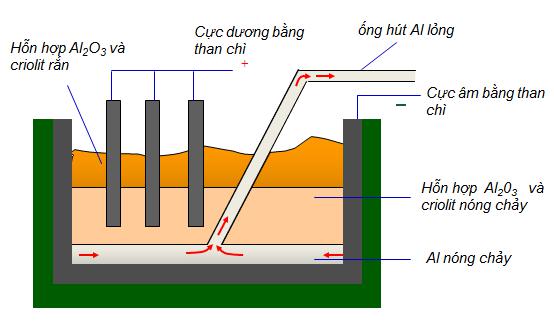
IV. ĐIỀU CHẾ
- Nguyên liệu để sản xuất nhôm là quặng bôxit có thành phần chủ yếu là Al2O3
Phương pháp: Điện phân hỗn hợp nóng chảy của nhôm oxit và criolit, thu được hỗn hợp nhôm và oxi
2Al2O3 ![]() \(\xrightarrow[c\text{r}i\text{o}lit]{{{t}^{o}}}\) 4Al + 3O2
\(\xrightarrow[c\text{r}i\text{o}lit]{{{t}^{o}}}\) 4Al + 3O2
B. Giải Hoá 9 bài 18
Tham khảo lời Giải bài tập Hoá 9 bài 18 tại đây: Giải Hóa 9 Bài 18: Nhôm
C. Trắc nghiệm Hoá 9 bài 18
............................................
Ngoài Lý thuyết Hóa học lớp 9 bài 18, mời các bạn tham khảo thêm Hóa học lớp 9, Giải bài tập Hóa học 9, Giải sách bài tập Hóa 9, Tài liệu học tập lớp 9 mới nhất được cập nhật.