Tài liệu bồi dưỡng học sinh giỏi Hóa lớp 9 phần hữu cơ


BỒI DƯỠNG HỌC SINH GIỎI HÓA LỚP 9
Nhằm giúp các bạn học sinh ôn tập kiến thức chuẩn bị cho kì thi học sinh giỏi lớp 9, VnDoc.com xin giới thiệu "Tài liệu bồi dưỡng học sinh giỏi Hóa lớp 9 phần hữu cơ". Tài liệu này bao gồm các kiến thức về hóa học hữu cơ, các dạng bài tập kèm phương pháp giải sẽ giúp các bạn tự ôn luyện dễ dàng. Mời các bạn cùng tham khảo.
Các chủ đề bồi dưỡng HS giỏi – Hoá 9 (Hoá hữu cơ)
ĐẠI CƯƠNG VỀ HOÁ HỌC HỮU CƠ.
1. Đặc điểm chung của các hợp chất hữu cơ.
Thành phần các nguyên tố tạo nên hợp chất hữu cơ rất ít, chủ yếu là các nguyên tố: C, H, O, N (và một số nguyên tố khác S, P, Cl, một số ít kim loại …). Nhưng số lượng các hợp chất hữu cơ rất nhiều.
Liên kết hoá học trong hợp chất hữu cơ chủ yếu là liên kết cộng hoá trị.
Phần lớn hợp chất hữu cơ dễ bay hơi, dễ cháy, kém bền với nhiệt.
Một số hợp chất hữu cơ không tan trong nước nhưng tan được trong dung môi hữu cơ.
Các phản ứng trong hoá học hữu cơ thường xảy ra chậm, không hoàn toàn và theo nhiều hướng khác nhau tạo nên hỗn hợp sản phẩm.
2. Phân loại hợp chất hữu cơ.
Hợp chất hữu cơ chia làm 2 loại:
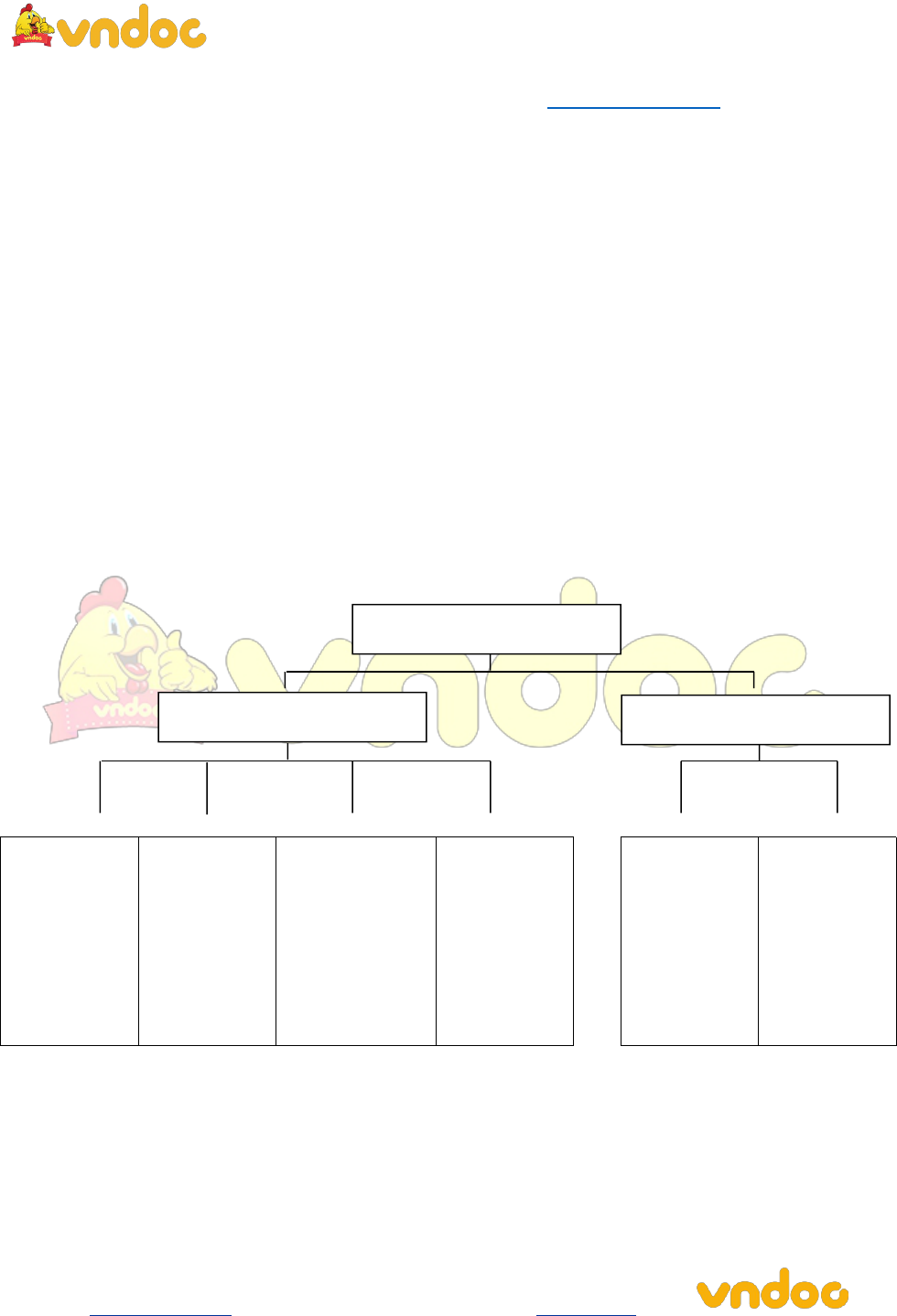
Hiđrocacbon: là hợp chất mà trong phân tử chỉ có C và H.
Dẫn xuất của hiđrocacbon: ngoài C, H còn có các nguyên tố khác như O, N, halogen… Dẫn xuất của hiđrocacbon gồm:
+ Dẫn xuất halogen: Khi thay thế một hoặc nhiều nguyên tử hiđro trong phân tử hiđrocacbon bằng một hoặc nhiều nguyên tử halogen ta được dẫn xuất halogen: CxHyClz, CxHyBrz, CxHyIz….
+ Dẫn xuất có oxi: Ancol, axit cacboxylic, este, chất béo, tinh bột, gluxic.
II. CẤU TẠO HOÁ HỌC.
2. Một số lưu ý khi viết CTCT. Giả sử hợp chất có CTPT:
Xác định độ bất bão hoà
Nếu => chỉ có cấu tạo mạch hở, liên kết đơn.
Nếu => Có 1 liên kết P hoặc 1 vòng.
Nếu => Có 2 liên kết P hoặc 1 vòng + 1 liên kết P.
III. DANH PHÁP HỢP CHẤT HỮU CƠ.
1. Tên thông thường.
Thường đặt tên theo nguồn gốc tìm ra chúng, đôi khi có phần đuôi để chỉ rõ hợp chất thuộc loại nào?
VD: Axit fomic HCOOH (formica: kiến)
Axit axetic CH3COOH (axetus: giấm)
Mentol C10H20O (metha piperita: bac hà)
2. Tên IUPAC.
a) Tên gốc chức: Tên phần gốc + tên phần địnhchức.
VD: CH3CH2Cl: etyl clorua
CH3 - CH2 - O - CH3: etyl metyl ete
b) Tên thay thế: Tên phần thế + tên mạch cacbon chính + tên phần địnhchức.
VD: CH3CH3: (et + an) etan
CH3 – CH2Cl (clo + et + an) cloetan
1 2 3 4
CH2 = CH – CH2 – CH3 but - 1 - en
3. Bảng tên số đếm và tên mạch cacbon chính.
| Số đếm | Mạch cacbon chính |
|
1 mono 2 đi 3 tri 4 tetra 5 penta 6 hexa 7 hepta 8 octa 9 nona 10 dec |
C met C-C et C-C-C prop C-C-C-C but C-C-C-C-C pent C-C-C-C-C-C hex C-C-C-C-C-C-C hept C-C-C-C-C-C-C-C oct C-C-C-C-C-C-C-C-C non C-C-C-C-C-C-C-C-C-C đec |
4. Đồng đẳng, đồng phân.
a. Đồng đẳng.
Đồng đẳng là những hợp chất có thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 nhưng có tính chất hoá học tương tự nhau.
VD: Dãy đồng đẳng của ankan: CH4, C2H6, C3H8 ... CnH2n+2
Khối lượng mol các chất trong cùng dãy đồng đẳng lập thành cấp số cộng công sai d = 14.
Lưu ý : Khái niệm đồng đẳng rất rộng, ở trên chỉ giới hạn đồng đẳng metylen.
b. Đồng phân.
Đồng phân là hiện tượng có 2 hay nhiều chất có cùng CTPT nhưng khác nhau về CTCT do đó khác nhau về tính chất hoá học.
Phân loại đồng phân: gồm đồng phân cấu tạo và đồng phân hình học. (Ở đây chỉ xét về đồng phân cấu tạo). Đồng phân cấu tạo gồm:
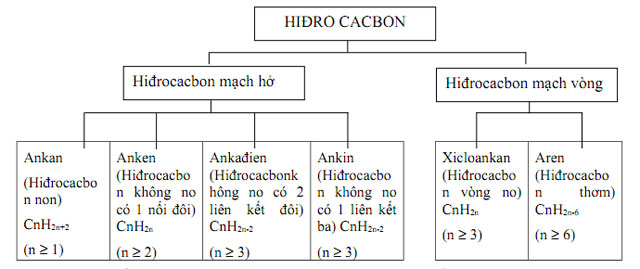
Đồng phân mạch cacbon: do sự sắp xếp mạch cacbon khác nhau
VD: CH3 – CH = CH – CH3;
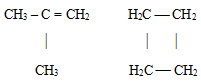
Đồng phân cách chia cắt mạch cacbon: do sự chia cắt mạch cacbon khác nhau.
VD: CH3COOCH3 và HCOOC2H5
Đồng phân vị trí: Do sự khác nhau về vị trí nối đôi, nối ba, nhóm thế hoặc nhóm chức trong phân tử.
Đồng phân nhóm chức: do sự thay đổi cấu tạo nhóm chức trong phân tử.
VD: CH3 – O – CH3 và CH3 – CH2 – OH
+ Đồng phân liên kết: do sự thay đổi liên kết giữa các nguyên tử cacbon với nhau.
VD: CH3 – CH2 – C ≡ CH và CH2 = CH – CH = CH2
IV. MỘT SỐ BÀI TẬP VIẾT CTCT CỦA HỢP CHẤT HỮU CƠ VÀ GỌI TÊN.
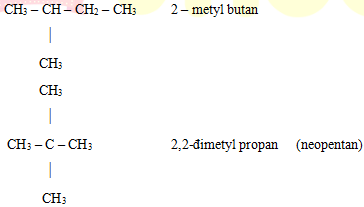
VD1: Viết CTCT của hợp chất C5H12.
Hướng dẫn: C5H12 thuộc dãy ankan chỉ có liên kết đơn trong phân tử và có 2 loại mạch: mạch thẳng và mạch nhánh. Chỉ có đồng phân về mạch cacbon.
CH3 – CH2 – CH2 – CH2 – CH3 Pentan
VD2: Viết CTCT của C4H8
Hướng dẫn: C4H8 thuộc dãy anken (hoặc thuộc dãy xicloankan) có 1 liên kết đôi trong phân tử, có cả 3 loại mạch (mạch vòng không có liên kết đôi). Có các đồng phân mạch cacbon, đồng phân vị trí.
CH2 = CH – CH2 – CH3 but – 1 – en
CH3 – CH = CH – CH3 but – 2 – en
VD3: Viết CTCT của C4H6
Hướng dẫn: C4H6 thuộc dãy ankin (hoặc thuộc dãy ankadien) có 1 liên kết ba (hoặc 2 liên kết đôi) trong phân tử , có cả 3 loại mạch (mạch vòng không có 1 liên kết đôi). Có các đồng phân mạch cacbon, đồng phân vị trí, đồng phân liên kết.
CH ≡ C – CH2 – CH3 but-1-in; CH3 – C ≡ C – CH3 but-2-in
CH2 = CH – CH = CH2 buta – 1,3 – đien
CH2 = C = CH – CH3 buta – 1,2 – đien
VD 4: Viết CTCT của C3H8O
Hướng dẫn: C3H8O thuộc dẫn xuất có oxi của hiđrocacbon có thể có các loại đồng phân nhóm chức, đồng phân vị trí. Mặt khác, C3H8 thuộc gốc no nên trong phân tử chỉ có liên kết đơn.
CH3 – CH2 – CH2 – OH propan-1-ol
CH3 – O – CH2 – CH3 etyl metyl ete
VD5: Viết CTCT của các xiclo ankan và gọi tên tương ứng với CTPT:
a) C5H10 ĐA: 5 cấu tạo
b) C6H12 ĐA: 10 cấu tạo
VD6: Viết CTCT của C7H16. ĐA: 9 cấu tạo.
V. LẬP CTHH DỰA VÀO SẢN PHẨM CHÁY.
1. Cơ sở lý thuyết.
- Nếu đề toán cho oxi hoá hoàn toàn hợp chất hữu cơ tức là đốt cháy hoàn toàn hợp chất hữu cơ.
- Nếu sản phẩm cháy được hấp thụ bởi bình đựng H2SO4 đặc hay P2O5 và bình đựng dung dịch kiềm thì lưu ý rằng N2 và O2 dư không bị hấp thụ.
- Những chất hấp thụ được nước : CaCl2 (khan), CuSO4 (khan), H2SO4đ, P2O5, CaO và dung dịch kiềm NaOH, KOH, Ca(OH)2, Ba(OH)2 ... => khối lượng của bình tăng lên là khối lượng của H2O bị hấp thụ.
- Những chất hấp thụ CO2 : dịch kiềm NaOH, KOH, Ca(OH)2, Ba(OH)2 ... => khối lượng của bình tăng lên là khối lượng của CO2 bị hấp thụ.
- Cần phân biệt khối lượng bình tăng và khối lượng dung dịch tăng.
+ mbình tăng = (mCO2 + mH2O) hấp thụ.
+ mdd tăng = (mCO2 + mH2O) hấp thụ - mkết tủa
+ mdd giảm = mkết tủa - (mCO2 + mH2O) hấp thụ
- Nếu đốt cháy hợp chất hữu cơ chứa C, H hoặc C, H, O rồi cho sản phẩm cháy qua bình 1 đựng PdCl2, bình 2 đựng dung dịch kiềm (Ca(OH)2, Ba(OH)2 dư.
=> sản phẩm cháy gồm CO, CO2, H2O. Trong đó CO bị hấp thụ bởi dung dịch PdCl2 theo PT: CO + PdCl2 + H2O -> Pd¯ + CO2 + 2HCl
=> bình dựng dung dịch kiềm hấp thụ CO2 có trong sản phẩm cháy và CO2 sinh ra do CO phản ứng với dung dịch PdCl2.
=> mC = mC (CO) + mC (CO2)
- Nếu đốt cháy hợp chất hữu cơ X bởi CuO thì khối lượng của bình CuO giảm đi là khối lượng của oxi tham gia phản ứng => để tìm khối lượng của chất hữu cơ đem đốt cháy cần lưu ý ĐLBTKL: mX + m bình giảm = mCO2 + mH2O.
2. Ví dụ minh hoạ.
Ví dụ 1: Đốt cháy hoàn toàn một lượng chất hữu cơ X cần 6,72 lít O2 (đktc). Khi cho toàn bộ sản phẩm cháy (chỉ có CO2 và H2O) vào một lượng nước vôi trong, thu được 10 gam kết tủa và 200 ml dung dịch muối có nồng độ 0,5M, dung dịch muối này nặng hơn nước vôi ban đầu là 8,6 gam. Xác định công thức đơn giản nhất của X.
Ví dụ 2: Đốt cháy hoàn toàn 0,01 mol chất hữu cơ X chứa C, H, O cần 0,784 lít O2 (đktc). Toàn bộ sản phẩm cháy cho qua bình 1 đựng dung dịch PdCl2 dư, bình 2 đựng dung dịch Ca(OH)2 dư. Sau thí nghiệm, bình 1 tăng 0,38 gam và xuất hiện 2,12 gam kết tủa, còn bình 2 có 3 gam kết tủa A. Xác định CTPT của X.
Ví dụ 3. Oxi hoá hoàn toàn 4,6g chất hữu cơ A bằng CuO đun nóng. Sau phản ứng thu được 4,48 lít CO2 (đktc) và nước, đồng thời nhận thấy khối lượng đồng oxit ban đầu giảm bớt 9,6 gam. Xác định CTPT của A.
Ví dụ 4. Đốt cháy hoàn toàn 2,3 gam một hợp chất hữu cơ X chỉ thu được CO2, H2O. Sản phẩm cháy cho hấp thụ hết vào bình đựng dung dịch nước vôi trong dư, thấy có 10 gam kết tủa xuất hiện và khối lượng bình đựng dung dịch nước vôi tăng 7,1 gam. Xác định CTPT của X. ĐS : C2H6O.
Ví dụ 5. Đốt cháy hoàn toàn một hợp chất hữu cơ X cần dùng 6,72 lít O2 (đktc). Sản phẩm cháy gồm CO2 và H2O cho hấp thụ hết vào bình đựng dung dịch Ba(OH)2 thấy có 19,7 gam kết tủa xuất hiện và khối lượng dung dịch giảm 5,5 gam. Lọc kết tủa, đun nóng nước lọc lại thu được 9,85 gam kết tủa nữa. Xác định CTPT của X. ĐS : C2H6O.
Ví dụ 6 . Đốt cháy hoàn toàn 0,282g chất hữu cơ A rồi cho các sản phẩm sinh ra đi lần lượt qua bình đựng CaCl2 khan và bình đựng KOH có dư. Sau thí nghiệm thấy bình đựng CaCl2 khan tăng thêm 0,189 gam, còn bình đựng KOH tăng thêm 0,8 gam.
Mặt khác, đốt 0,186g A thì thu được 22,4 ml N2 (đktc). Biết phân tử A chỉ chứa 1 nguyên tử N. Tìm CTPT của A. ĐS : C6H7N.
Ví dụ 7. Đốt cháy hoàn toàn 10,4g chất hữu cơ A rồi cho sản phẩm cháy lần lượt qua bình 1 đựng H2SO4đ và bình 2 chứa nước vôi trong dư, thấy khối lượng bình 1 tăng 3,6g, bình 2 thu được 30g kết tủa. Khi hoá hơi 5,2g A thu được một thể tích đúng bằng thể tích của 1,6 gam oxi ở cùng điều kiện. Xác định CTPT của A. ĐS : C3H4O4.
Ví dụ 8. Đốt cháy hoàn toàn a gam một hiđrocacbon A, sản phẩm cháy được dẫn qua bình chứa nước vôi trong dư, người ta thu được 3 gam kết tủa, đồng thời bình chứa nặng thêm 1,68 gam.
- Tính a. ĐS : 0,4g
- Xác định CTPT của A, biết tỉ khối hơi của A đối với metan là 2,5. ĐS : C3H4
Ví dụ 9. Đốt cháy hoàn toàn 0,01 mol chất hữu cơ X cần vừa đủ 0,616 lít O2. Sau thí nghiệm thu được 1,344 lít hỗn hợp sản phẩm X gồm : CO2, N2 và hơi nước. Làm lạnh để ngưng tụ hơi nước thì còn lại 0,56 lít hỗn hợp khí Z (có tỉ khối đối với H2 là 20,4). Xác định CTPT của X, biết thể tích các khí đo ở đktc. ĐS : C2H7O2N
Ví dụ 10. Đốt cháy hoàn toàn 1,48 gam chất hữu cơ A cần dùng 2,016 lít O2 ở đktc. Sau phản ứng thu được hỗn hợp khí có thành phần như sau :
VCO2 = 3VO2 dư và mCO2 = 2,444.mH2O. Tìm CTPT của A. Biết khí hoá hơi 1,85 gam A chiểm thể tích bằng thể tích của 0,8 gam oxi ở cùng điều kiện. ĐS : C3H6O2.
Ví dụ 11. Đốt cháy hết 0,75 gam chất hữu cơ A. Hơi sản phẩm cháy được dẫn toàn bộ qua bình đựng dung dịch nước vôi trong dư. Khối lượng bình tăng 1,33g, trong đó lọc tách được 2gam một chất kết tủa.
Mặt khác, khi phân tích 0,15 gam A, khí NH3 sinh ra được dẫn vào 180ml dung dịch H2SO4 0,1M. Lượng axit dư được trung hoà vừa đúng bằng 4ml dung dịch NaOH 0,4M. Xác định CTPT của A, biết 1 lít khí A ở đktc nặng 3,35 gam. ĐS : C2H5O2N.
Ví dụ 12. Đốt cháy hoàn toàn 0,4524g một chất hữu cơ A sinh ra 0,3318g CO2 và 0,2714g H2O.
Đun nóng 0,3682g chất A với vôi tôi, xút để chuyển tất cả N trong A thành NH3 rồi dẫn khí NH3 vào 200ml dung dịch H2SO4 0,5M. Để trung hoà axit còn dư, cần dùng 7,7ml dung dịch NaOH 1M.
- Tính thành phần % các nguyên tố trong A.
- Xác định CTPT của A, biết tỉ khối hơi của nó đối với khí nitơ là 2,143. ĐS:CH4ON2
....................................
Tài liệu bồi dưỡng học sinh giỏi Hóa lớp 9 phần hữu cơ. Tài liệu gồm lý thuyết kèm bài tập giúp cho các bạn tự rèn luyện tại nhà biết cách phân bổ thời gian làm bài. Mời các bạn tham khảo tài liệu trên





