Đề thi Olympic môn Hóa học lớp 10 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017
Đề thi Olympic môn Hóa học lớp 10
Đề thi Olympic môn Hóa học lớp 10 trường THPT Đa Phúc, Hà Nội năm học 2016 - 2017 với nhiều câu hỏi khó giúp các em làm quen với dạng đề, và biết cách giải các bài tập đòi hỏi độ tư duy cao. Hy vọng sẽ là tài liệu tham khảo có giá trị cho quý thầy cô và các em học sinh.
Đề thi Olympic tháng 4 TP. HCM lần 1 môn Hóa học lớp 10 năm 2015
Đề thi học sinh giỏi môn Hóa học lớp 10 trường THPT Lam Kinh, Thanh Hóa năm học 2015-2016
|
Trường THPT Đa Phúc |
ĐỀ THI OLYMPIC |
|
Năm học: 2016-2017 |
Môn: Hóa học 10 |
|
---------š&›---------- |
Thời gian làm bài: 90 phút |
Câu 1. (3,0 điểm)
Trong phân tử MX2 có tổng số hạt p, n, e bằng 164 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 52 hạt. Số khối của nguyên tử M lớn hơn số khối của nguyên tử X là 5. Tổng số hạt p,n,e trong nguyên tử M lớn hơn trong nguyên tử X là 8 hạt. Xác định vị trí của các nguyên tố M, X trong Bảng tuần hoàn?
Câu 2. (4,0 điểm) Hoàn thành và cân bằng các phản ứng hóa học sau theo phương pháp thăng bằng electron:
a) Mg + HNO3 → Mg(NO3)2 + N2O + N2 + NH4NO3 + H2O
(biết tỉ lệ mol của N2O : N2 : NH4NO3 là 1 : 2: 1)
b) M2(CO3)n + HNO3 đặc, nóng → M(NO3)m + NO2 + CO2 + H2O
c) CuFeSx + O2 → Cu2O + Fe3O4 + SO2↑
d) Fe3O4 + HNO3 → NxOy + ...
Câu 3. (3,0 điểm)
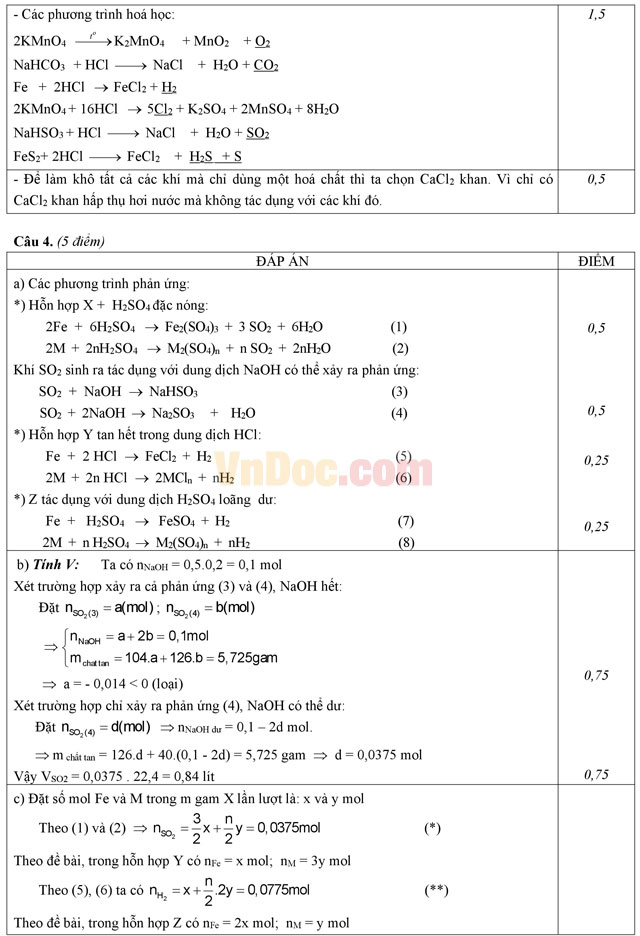
Từ KMnO4, NaHCO3, Fe, CuS, NaHSO3, FeS2 và dung dịch HCl đặc có thể điều chế được những khí gì? Viết phương trình hoá học.
Khi điều chế các khí trên thường có lẫn hơi nước, để làm khô tất cả các khí đó chỉ bằng một hoá chất thì nên chọn chất nào trong số các chất sau đây: CaO, CaCl2 khan, H2SO4 đặc, P2O5, NaOH rắn. Giải thích (Không cần viết phương trình hoá học).
Câu 4. (5,0 điểm)
Hỗn hợp X gồm Fe và kim loại M (hóa trị n không đổi). Hòa tan hoàn toàn m gam X trong dung dịch H2SO4 đặc nóng, dư được dung dịch A và V lít khí SO2 (đktc) là sản phẩm khử duy nhất. Hấp thụ hoàn toàn lượng SO2 trên bằng 500 ml dung dịch NaOH 0,2M được dung dịch chứa 5,725 gam chất tan.
Thêm vào m gam X lượng M gấp đôi lượng M ban đầu được hỗn hợp Y. Cho Y tan hết trong dung dịch HCl được 1,736 lít H2 (đktc).
Thêm một lượng Fe vào m gam X để được hỗn hợp Z chứa lượng sắt gấp đôi lượng sắt có trong X. Cho Z tác dụng với dung dịch H2SO4 loãng dư được dung dịch B chứa 5,605 gam muối.
a) Viết các phương trình hóa học của các phản ứng xảy ra.
b) Tính V.
c) Tìm kim loại M và thành phần % theo khối lượng mỗi kim loại trong X.
Câu 5. (5,0 điểm)
Dung dịch X là dung dịch HCl. Dung dịch Y là dung dịch NaOH. Cho 60 ml dung dịch X vào cốc chứa 100 gam dung dịch Y, tạo ra dung dịch chỉ chứa một chất tan. Cô cạn dung dịch thu được 14,175 gam chất rắn Z. Nung Z đến khối lượng không đổi, thì chỉ còn lại 8,775 gam chất rắn.
a) Tìm nồng độ mol/l của dung dịch X, nồng độ phần trăm của dung dịch Y và công thức của Z.
b) Cho 16,4 gam hỗn hợp X1 gồm Al, Fe vào cốc đựng 840 ml dung dịch X. Sau phản ứng thêm tiếp 1600 gam dung dịch Y vào cốc. Khuấy đều cho phản ứng hoàn toàn, lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi thu được 13,1 gam chất rắn Y1. Tìm thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp X1.
--------------------000--------------------
(Cho nguyên tử khối của các nguyên tố: H = 1, C = 12, O = 16, Mg = 24, Al = 27, S = 32, Cl = 35.5, Ca = 40, Fe = 56, Cu = 64, Zn = 65)
Chú ý: Học sinh không được sử dụng bảng tuần hoàn. Cán bộ coi thi không giải thích gì thêm.
Đáp án đề thi Olympic môn Hóa học lớp 10