Đề thi học sinh giỏi môn Hóa học lớp 10 trường THPT Lam Kinh, Thanh Hóa
Đề thi học sinh giỏi môn Hóa học lớp 10
Đề thi học sinh giỏi môn Hóa học lớp 10 trường THPT Lam Kinh, Thanh Hóa năm học 2015- 2016 là đề thi học sinh giỏi lớp 10 môn Hóa có kèm theo đáp án. Đây là tài liệu bồi dưỡng học sinh giỏi môn Hóa hay, giúp các bạn học sinh tự ôn tập kiến thức, làm quen với dạng đề thi học sinh giỏi cũng như rèn luyện tư duy và cách trình bày khoa học. Mời các bạn tham khảo.
|
TRƯỜNG THPT LAM KINH -------------------
|
KỲ THI CHỌN HỌC SINH GIỎI LỚP 10 NĂM HỌC 2015-2016 ĐỀ THI MÔN: HOÁ HỌC (Thời gian làm bài: 150 phút, không kể thời gian giao đề) |
Bài 1 (4 điểm).
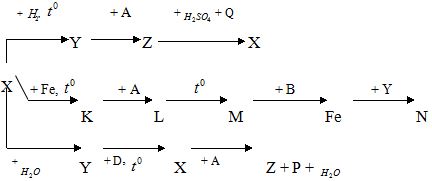
- Xác định công thức các chất và viết phương trình phản ứng biểu diễn theo sơ đồ biến đổi hóa học sau:

- Đốt cháy hoàn toàn 12,8 gam lưu huỳnh. Khí sinh ra được hấp thụ hết bởi 100 ml dung dịch NaOH 20% (d = 1,28 g/ml). Tìm C% của các chất trong dung dịch thu được sau phản ứng.
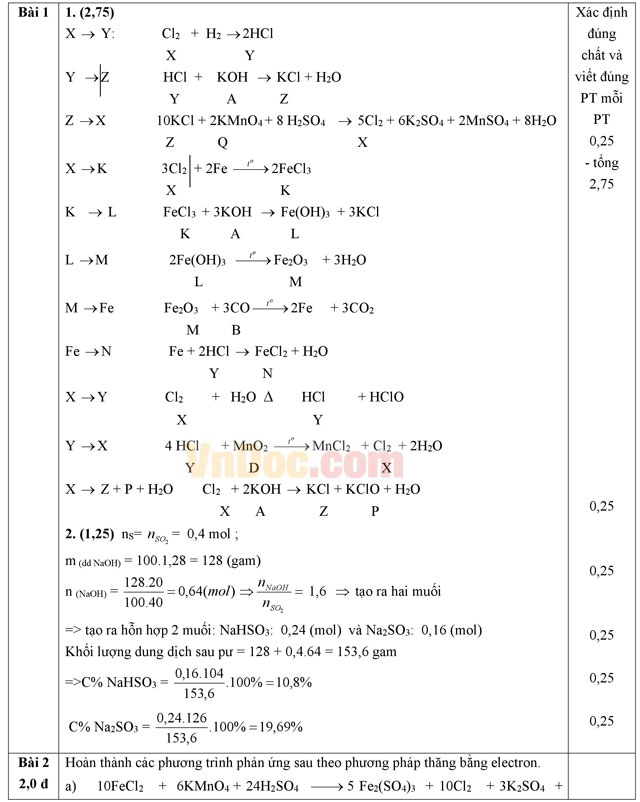
Bài 2 (2,0 điểm). Hoàn thành các phương trình phản ứng sau theo phương pháp thăng bằng electron.
a) FeCl2 + KMnO4 + H2SO4 → Fe2(SO4)3 + Cl2 + K2SO4 + MnSO4 + H2O
b) Mg + HNO3 → Mg(NO3)2 + N2O + N2 + NH4NO3 + H2O
(biết tỉ lệ mol của N2O : N2 : NH4NO3 là 1 : 2: 1)
c) Fe3O4 + HNO3 → NxOy + ...
d) Al + NaNO3 + NaOH + H2O → NaAlO2 + NH3
Bài 3 (2,5 điểm). Từ KMnO4, NaHCO3, Fe, CuS, NaHSO3, FeS2 và dung dịch HCl đặc có thể điều chế được những khí gì? Viết phương trình hoá học.
Khi điều chế các khí trên thường có lẫn hơi nước, để làm khô tất cả các khí đó chỉ bằng một hoá chất thì nên chọn chất nào trong số các chất sau đây: CaO, CaCl2 khan, H2SO4 đặc, P2O5, NaOH rắn. Giải thích (Không cần viết phương trình hoá học).
Bài 4 (2,5 điểm) Ion M3+ có cấu hình electron lớp ngoài cùng là 3s23p63d5.
- Xác định vị trí (số thứ tự, chu kỳ, nhóm) của M trong bảng tuần hoàn. Cho biết M là kim loại gì?
- Trong điều kiện không có không khí, cho M cháy trong khí Cl2 thu được một chất A và nung hỗn hợp bột (M và S) được một hợp chất B. Bằng các phản ứng hóa học, hãy trình bày phương pháp nhận biết thành phần của các nguyên tố có mặt trong các chất A và B.
Bài 5 (3 điểm). Cho a gam bột sắt ngoài không khí, sau một thời gian thu được hỗn hợp A có khối lượng 37,6 gam gồm Fe, FeO, Fe2O3 và Fe3O4. Cho hỗn hợp A phản ứng hết với dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc).
a) Tính a.
b) Tính số mol H2SO4 đã phản ứng.
Bài 6: (3 điểm) Cho 20,4 gam hỗn hợp X gồm Zn, Fe, Al tác dụng với dung dịch HCl dư thu được 10,08 lít H2 ở đktc. Mặt khác cho 0,2 mol hỗn hợp X tác dụng vừa đủ với 6,16 lít Cl2 ở đktc. Xác định khối lượng mỗi kim loại trong 20,4 gam hỗn hợp X?
Bài 7 (3 điểm) Nung a gam hỗn hợp X gồm Fe và S trong điều kiện không có không khí cho đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn Y. Chia Y thành hai phần bằng nhau. Cho phần 1 tác dụng với dung dịch HCl dư thu được hỗn hợp khí Z có dZ/H2 = 13.
- Tính phần trăm khối lượng mỗi chất trong X.
- Cho phần 2 tác dụng hết với 55 gam dung dịch H2SO4 98%, đun nóng thu được V lít khí SO2 (đktc) và dung dịch A. Cho dung dịch A tác dụng hết với dung dịch BaCl2 dư tạo thành 58,25 gam kết tủa. Tính a, V.
Học sinh không được sử dụng bảng tuần hoàn các nguyên tố hoá học.
(Biết: H = 1, O = 16, C = 12, Cl = 35,5, Mg = 24, Fe = 56, Zn = 65, Ca = 40, Pb = 207; Al = 27; S = 32; Ba = 137; ZCa = 20; ZMg = 12; ZAl = 13; ZFe= 26; ZCu = 29; ZCr = 24)
Đáp án đề thi học sinh giỏi môn Hóa học lớp 10
Bài 1.
1. (2,75)
X → Y: Cl2 + H2 → 2HCl
X Y
Y → Z: HCl + KOH → KCl + H2O
Y A Z
Z → X 10KCl + 2KMnO4 + 8 H2SO4 → 5Cl2 + 6K2SO4 + 2MnSO4 + 8H2O
Z Q X
X → K 3Cl2 + 2Fe ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
\(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
X K
K → L FeCl3 + 3KOH → Fe(OH)3 + 3KCl
K A L
L → M 2Fe(OH)3 ![]() \(\overset{t^{\circ } }{\rightarrow}\)Fe2O3 + 3H2O
\(\overset{t^{\circ } }{\rightarrow}\)Fe2O3 + 3H2O
L M
M → Fe Fe2O3 + 3CO ![]() \(\overset{t^{\circ } }{\rightarrow}\)2Fe + 3CO2
\(\overset{t^{\circ } }{\rightarrow}\)2Fe + 3CO2
M B
Fe → N Fe + 2HCl → FeCl2 + H2O
Y N
X → Y Cl2 + H2O → HCl + HClO
X Y
Y → X 4 HCl + MnO2 ![]() \(\overset{t^{\circ } }{\rightarrow}\)MnCl2 + Cl2 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\)MnCl2 + Cl2 + 2H2O
Y D X
X → Z + P + H2O Cl2 + 2KOH → KCl + KClO + H2O
X A Z P



..............................................
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Đề thi học sinh giỏi môn Hóa học lớp 10 trường THPT Lam Kinh, Thanh Hóa năm học 2015- 2016. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Hóa học lớp 10, Thi thpt Quốc gia môn Văn, Thi thpt Quốc gia môn Lịch sử, Thi thpt Quốc gia môn Địa lý, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.