Lý thuyết Hóa học 12 bài 22: Luyện tập tính chất của kim loại
Lý thuyết Hóa học 12 bài 22: Luyện tập tính chất của kim loại được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Luyện tập tính chất của kim loại
1. Tóm tắt lý thuyết
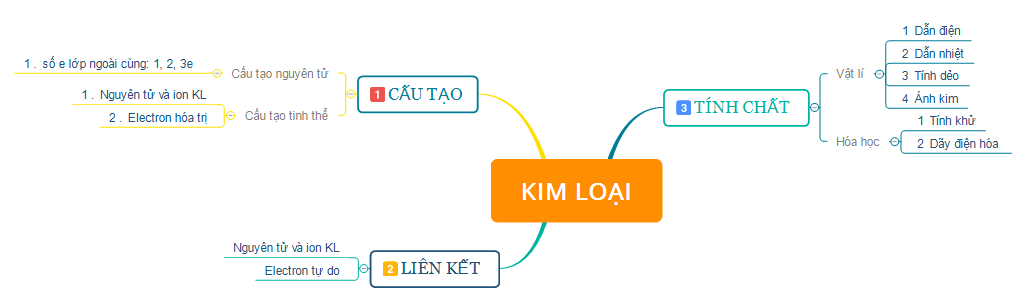
2. Bài tập minh họa
2.1. Bài tập Tính chất của kim loại - Cơ bản
a. Kim loại có độ cứng lớn nhất là Cr.
b. Kim loại dẫn điện tốt nhất là Cu.
c. Kim loại có nhiệt độ nóng chảy cao nhất là W.
d. Kim loại có khối lượng riêng nhỏ nhất là Li.
Hướng dẫn:a. Đúng. Kim loại cứng nhất là Cr, kim loại mềm nhất là Cs.
b. Sai. Độ dẫn điện giảm dần theo dãy: Ag > Cu > Au > Al > Fe.
c. Đúng. Kim loại có nhiệt độ nóng chảy cao nhất là W, kim loại có độ nóng chảy thấp nhất là Hg.
d Đúng. Kim loại có khối lượng riêng lớn nhất là Os, kim loại có khối lượng riêng nhỏ nhất là Li.
Bài 2: Cho hỗn hợp X gồm Fe, Cu vào dung dịch HNO3 loãng, nóng thu được khí NO, dung dịch Y và còn lại chất rắn chưa tan Z. Cho Z tác dụng với dung dịch H2SO4 loãng thấy có khí thoát ra. Thành phần chất tan trong dung dịch Y làTheo thứ tự phản ứng thì Fe phản ứng trước
![]() \(Fe + 4HN{O_3} \to Fe{(N{O_3})_3} + N{O^ \uparrow } + 2{H_2}O\)
\(Fe + 4HN{O_3} \to Fe{(N{O_3})_3} + N{O^ \uparrow } + 2{H_2}O\)
X + HNO3 loãng nóng -> Y + chất rắn Z không tan
=> Z có Cu và có thể có Fe(dư)
Vì Z + H2SO4 loãng thấy có khí thoát => Z phải có Fe dư
![]() \(F{e_{(du)}} + 2Fe{(N{O_3})_3} \to 3Fe{(N{O_3})_2}\)
\(F{e_{(du)}} + 2Fe{(N{O_3})_3} \to 3Fe{(N{O_3})_2}\)
=> trong Y chỉ có Fe(NO3)2
Bài 3: Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3 khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (gồm 2 muối) và chất rắn Y (gồm 2 kim loại). 2 muối trong X là:(1) Mg + 2Ag+ → Mg2+ + 2Ag
(2) Fe + 2Ag+ → Fe2+ + 2Ag
(3) Fe2+ + Ag+ → Fe3+ + Ag
Vì Chất rắn Y gồm 2 kim loại ⇒ đó là Ag và Fe ⇒ không thể xảy ra (3) và Ag+ phải hết
⇒ X gồm Mg2+ và Fe2+
2.2. Bài tập Tính chất của kim loại - Nâng cao
Bảo toàn khối lượng: mX + mO (pứ) = mY => nO(pứ) = 0,5 mol
Phản ứng tổng quát: ![]() \(O + 2{H^ + } \to {H_2}O\)
\(O + 2{H^ + } \to {H_2}O\)
![]() \(\Rightarrow {n_{HCl}} = 2{n_{{O^{2 - }}}} = 2.0,5 = 1{\rm{ }}(mol)\)
\(\Rightarrow {n_{HCl}} = 2{n_{{O^{2 - }}}} = 2.0,5 = 1{\rm{ }}(mol)\)
=> Vdd HCl = 0,5 lit = 500 ml
Bài 2: Cho a mol Fe phản ứng vừa đủ với b mol H2SO4 (đặc, nóng) thu được khí SO2 (sản phẩm khử duy nhất) và 5,04 gam muối. Biết tỉ lệ a : b = 3 : 7. Giá trị của a là:Muối gồm:![]() \(\left\{\begin{matrix} FeSO_{4}: \ x \ mol \ \ \ \ \\ Fe_{2}(SO_{4})_{3}: \ y \ mol \end{matrix}\right. \rightarrow 152x+400y = 5,04 \ \ (1)\)
\(\left\{\begin{matrix} FeSO_{4}: \ x \ mol \ \ \ \ \\ Fe_{2}(SO_{4})_{3}: \ y \ mol \end{matrix}\right. \rightarrow 152x+400y = 5,04 \ \ (1)\)
Số mol e nhường = 2x + 6y → Số mol SO2 = x + 3y
→ Số mol H2SO4 phản ứng = 2x + 6y (mol)
Theo bài ra ta có:![]() \(\frac{n_{Fe}}{n_{H_{2}SO_{4}}} = \frac{3}{7} \Rightarrow \frac{x+2y}{2x+6y} = \frac{3}{7} \Rightarrow x - 4y = 0 \ \ (2)\)
\(\frac{n_{Fe}}{n_{H_{2}SO_{4}}} = \frac{3}{7} \Rightarrow \frac{x+2y}{2x+6y} = \frac{3}{7} \Rightarrow x - 4y = 0 \ \ (2)\)
Giải (1) và (2) ta được:
![]() \(\left\{\begin{matrix} x = 0,02 \ \\ y = 0,005 \end{matrix}\right. \Rightarrow a = x + 2y = 0,03 \ (mol)\)
\(\left\{\begin{matrix} x = 0,02 \ \\ y = 0,005 \end{matrix}\right. \Rightarrow a = x + 2y = 0,03 \ (mol)\)
3. Luyện tập Bài 22 Hóa học 12
Sau bài học cần nắm:
- tính chất vật lí, hóa học của kim loại
- vận dụng vào việc giải các bài tập liên quan đến kim loại.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 12 Bài 22 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
A. Ag
B. Cu
C. Al
D. Au
A. NaOH
B. Ag
C. BaCl2
D. Fe
A. Thanh Fe có màu trắng và dung dịch nhạt dần màu xanh
B. Thanh Fe có màu đỏ và dung dịch nhạt dần màu xanh
C. Thanh Fe có màu xám và dung dịch nhạt dần màu xanh
D. Thanh Fe có màu đỏ và dung dịch dần có màu xanh
A. 12,18.
B. 8,40.
C. 7,31.
D. 8,12.
A. 0,10.
B. 0,12.
C. 0,4.
D. 0,8.
--------------------------------------
Trên đây VnDoc.com vừa giới thiệu tới các bạn Lý thuyết Hóa học 12 bài 22: Luyện tập tính chất của kim loại, mong rằng qua đây các bạn có thể học tập tốt hơn môn Hóa học nhé. Mời các bạn cùng tham khảo thêm kiến thức các môn: Toán 12, Vật lý 12, Giải bài tập Toán 12, Giải bài tập Hóa 12,...




