Lý thuyết Hóa học 12 bài 20: Sự ăn mòn kim loại
Lý thuyết Hóa học 12 bài 20: Sự ăn mòn kim loại được chúng tôi sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Sự ăn mòn kim loại
1. Khái niệm về Ăn mòn kim loại
Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh
Kim loại bị oxi hoá thành ion dương
M → Mn+ + ne
2. Các dạng ăn mòn
a. Ăn mòn hóa học
Ví dụ: Cổng sắt bị rỉ sét do ăn mòn hóa học:
![]() \(3Fe+2O_{2}\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}\)
\(3Fe+2O_{2}\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}\)
![]() \(3Fe+2H_{2}O\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}+2H_{2}\)
\(3Fe+2H_{2}O\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}+2H_{2}\)
⇒ Ăn mòn hoá học là quá trình oxi hoá – khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
b. Ăn mòn điện hóa học
Thí nghiệm: Ăn mòn điện hóa với 2 điện cực là Zn và Cu
Giải thích hiện tượng:
- Điện cực âm (anot); Zn bị ăn mòn theo phản ứng: Zn → Zn2+ + 2e. Ion Zn2+ đi vào dung dịch, các electron theo dây dẫn sang điện cực Cu.
- Điện cực dương (catot): ion H+ của dung dịch H2SO4 nhận electron biến thành nguyên tử H rồi thành phân tử H2 thoát ra. 2H+ + 2e → H2
Ăn mòn điện hóa là quá trình oxi hóa – khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
Ăn mòn điện hóa học hợp kim sắt trong không khí ẩm
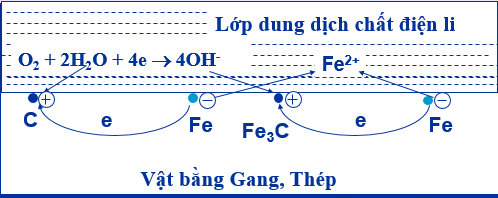
Tại anot: Fe → Fe2+ + 2e; Tại catot: O2 + 2H2O + 4e → 4OH-
Điều kiện để xảy ra ăn mòn điện hóa học
- Các điện cực phải khác nhau về bản chất. Cặp KL – KL; KL – PK; KL – Hợp chất hoá học
- Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp qua dây dẫn.
- Các điện cực cùng tiếp xúc với một dung dịch chất điện li.
3. Chống ăn mòn kim loại
a. Phương pháp bảo vệ bề mặt
Dùng những chất bền vững với môi trường để phủ mặt ngoài những đồ vật bằng kim loại như bôi dầu mỡ, sơn, mạ, tráng men,…
Ví dụ: Mạ tượng, sơn phủ bên ngoài đồ vật,..
b. Phương pháp điện hóa
Nối kim loại cần bảo vệ với một kim loại hoạt động hơn để tạo thành pin điện hóa và kim loại hoạt động hơn sẽ bị ăn mòn, kim loại kia được bảo vệ.
Ví dụ: Bảo vệ vỏ tàu biển làm bằng thép bằng cách gán vào mặt ngoài của vỏ tàu (phần chìm dưới nước) những khối Zn, kết quả là Zn bị nước biển ăn mòn thay cho thép.
4. Bài tập minh họa
Bài 1:
Cho các hợp kim sau: Cu-Fe (I); Zn-Fe (II); Fe-C (III); Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là:
Hướng dẫn:
- Trong cặp điện cực: kim loại – kim loại thì kim loại nào có tính khử mạnh hơn đóng vai trò là cực âm (anot) thì kim loại đó bị ăn mòn khi tiếp xúc với dung dịch chất điện li. (Mẹo: Dựa vào dãy điện hóa của kim loại. .Cái nào càng mạnh thì càng bị ăn mòn. Ví dụ như cặp Cu - Fe. Fe là kim loại mạnh hơn Cu nên Fe bị ăn mòn)
- Trong cặp điện cực: kim loại – phi kim thường hay gặp nhất là Fe – C thì kim loại đóng vai trò là cực âm và bị ăn mòn khi tiếp xúc với dung dịch chất điện li.
- Do vậy các cặp hợp kim thỏa mãn là: I, III, IV.
Bài 2:
Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl3, AgNO3. Nhúng vào mỗi dung dịch một thanh Ni. Số trường hợp xuất hiện ăn mòn điện hoá là
Hướng dẫn:
Ăn mòn điện hóa
điều kiện: 2 kim loại, kim loại - phi kim (gang, thép)
![]() \(Ni + Cu2+ \rightarrow Ni2+ + Cu\downarrow\)
\(Ni + Cu2+ \rightarrow Ni2+ + Cu\downarrow\)
![]() \(Ni + Fe3+ \rightarrow Ni2+ + Fe2+\)
\(Ni + Fe3+ \rightarrow Ni2+ + Fe2+\)
![]() \(Ni + Ag+ \rightarrow Ni2+ + Ag\downarrow\)
\(Ni + Ag+ \rightarrow Ni2+ + Ag\downarrow\)
Vậy số trường ăn mòn điện hóa là 2.
Bài 3:
Nhúng thanh kim loại Fe vào các dung dịch sau: FeCl3; CuCl2; H2SO4 (loãng) + CuSO4; H2SO4 loãng; AgNO3. Số trường hợp thanh kim loại sắt tan theo cơ chế ăn mòn điện hóa là:
Hướng dẫn:
CuCl2; H2SO4 loãng + CuSO4; AgNO3
--------------------------------------
Trên đây VnDoc.com vừa giới thiệu tới các bạn Lý thuyết Hóa học 12 bài 20: Sự ăn mòn kim loại, mong rằng qua đây các bạn có thể học tập tốt hơn môn Hóa học nhé. Mời các bạn cùng tham khảo thêm kiến thức các môn: Toán 12, Vật lý 12, Giải bài tập Toán 12, Giải bài tập Hóa 12,...









