Lý thuyết Hóa học 12 bài 31: Sắt
Lý thuyết Hóa học 12 bài 31: Sắt được chúng tôi sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Sắt
1. Vị trí trong Bảng tuần hoàn, cấu hình electron nguyên tử
Cấu hình electron: 1s22s22p63s23p63d64s2 hay [Ar]3d64s2
Ô thứ 26, nhóm VIIIB, chu kì 4
Sắt dễ nhường 2 electron ở phân lớp 4s trở thành ion Fe2+ và có thể nhường thêm 1 electron ở phân lớp 3d để trở thành ion Fe3+.
2. Tính chất vật lí
Quan sát Con cá Sắt giúp ngăn ngừa bệnh thiếu máu

Sắt là kim loại màu trắng hơi xám
Có khối lượng riêng lớn (d = 8,9 g/cm3), nóng chảy ở 15400C.
Sắt có tính dẫn điện, dẫn nhiệt tốt và có tính nhiễm từ.
3. Tính chất hóa học
Là kim loại có tính khử trung bình.
Với chất oxi hóa yếu: Fe → Fe2+ + 2e
Với chất oxi hóa mạnh: Fe → Fe3+ + 3e
a. Tác dụng với Phi kim
Thí nghiệm: Sắt phản ứng với Lưu huỳnh:![]() \(Fe+S\overset{t^{0}}{\rightarrow}FeS\)
\(Fe+S\overset{t^{0}}{\rightarrow}FeS\)
Thí nghiệm: Sắt cháy trong Oxi: ![]() \(Fe+O_{2}\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}\)
\(Fe+O_{2}\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}\)
Thí nghiệm: Sắt tác dụng với Clo: ![]() \(2Fe+3Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}\)
\(2Fe+3Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}\)
b. Tác dụng với axit
Với dung dịch HCl, H2SO4 loãng: Fe đưa về sắt (II), H+ chuyển thành H2
Thí nghiệm của Sắt trong dung dịch sunfuric loãng:
![]() \(Fe + H_{2}SO_{4}\rightarrow FeSO_{4}+H_{2}\uparrow\)
\(Fe + H_{2}SO_{4}\rightarrow FeSO_{4}+H_{2}\uparrow\)
Với dung dịch HNO3 và H2SO4 đặc, nóng: Fe khử N+5 hoặc S+6 trong HNO3 hoặc H2SO4 đặc, nóng đến số oxi hoá thấp hơn, còn Fe bị oxi hoá thành Fe3+.
Thí nghiệm: Sắt trong dung dịch HNO3 loãng:
![]() \(Fe+4HNO_{3}\rightarrow Fe(NO_{3})_{3}+NO\uparrow+2H_{2}O\)
\(Fe+4HNO_{3}\rightarrow Fe(NO_{3})_{3}+NO\uparrow+2H_{2}O\)
Lưu ý: Fe bị thụ động bởi các axit HNO3 đặc, nguội hoặc H2SO4 đặc, nguội.
c. Tác dụng với dung dịch muối
Sắt có thể khử được các ion của các kim loại đứng sau nó trong dãy điện hóa.
Thí nghiệm: Sắt phản ứng với dung dịch Đồng(II) sunfat
![]() \(Fe+CuSO_{4}\rightarrow FeSO_{4}+Cu\downarrow\)
\(Fe+CuSO_{4}\rightarrow FeSO_{4}+Cu\downarrow\)
d. Tác dụng với nước
Hình vẽ mô phỏng thí nghiệm: Sắt khử hơi nước ở nhiệt độ cao
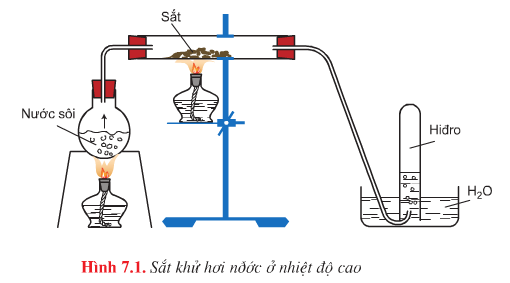
Phương trình hóa học:
![]() \(3Fe+4H_{2}O\overset{t^{0}<570^{0}C}{\rightarrow}Fe_{3}O_{4}+4H_{2}\uparrow\)
\(3Fe+4H_{2}O\overset{t^{0}<570^{0}C}{\rightarrow}Fe_{3}O_{4}+4H_{2}\uparrow\)
![]() \(Fe+H_{2}O\overset{t^{0}>570^{0}C}{\rightarrow}FeO+H_{2}\uparrow\)
\(Fe+H_{2}O\overset{t^{0}>570^{0}C}{\rightarrow}FeO+H_{2}\uparrow\)
4. Ứng dụng
Chiếm khoảng 5% khối lượng vỏ trái đất, đứng hàng thứ hai trong các kim loại (sau Al).
Trong tự nhiên sắt chủ yếu tồn tại dưới dạng hợp chất có trong các quặng:
- quặng manhetit (Fe3O4)
- quặng hematit đỏ (Fe2O3)
- quặng hematit nâu (Fe2O3.nH2O)
- quặng xiđerit (FeCO3)
- quặng pirit (FeS2)
Có trong hemoglobin (huyết cầu tố) của máu
Có trong các thiên thạch.
5. Bài tập Sắt - Cơ bản
Bài 1: Cho m gam kim loại Fe tác dụng với dung dịch HNO3 dư, sau phản ứng thu được 3,36 lít khí NO đo ở đktc (sản phẩm khử duy nhất). Giá trị m là:
Hướng dẫn:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,15 0,15
⇒ m Fe = 0,15. 56 = 8,4 gam
Bài 2: Cho 4,368 gam bột Fe tác dụng với m gam bột S. Sau phản ứng được rắn X. Toàn bộ X tan hết trong dung dịch HNO3 loãng dư được sản phẩm khử duy nhất là 0,12 mol NO. Giá trị m là:
Hướng dẫn:
Coi hỗn hợp X gồm Fe và S phản ứng với HNO3
Fe → Fe3+ + 3e
S → S6+ + 6e
N5+ + 3e → N2+
Bảo toàn e: 3nFe + 6nS = 3nNO
⇒ nS = 0,021 mol
⇒ m = 0,672g
Bài 3: Cho m gam Fe vào bình đựng dung dịch H2SO4 và HNO3 thu được dung dịch X và 1,12 lít khí NO. Thêm tiếp H2SO4 dư vào bình được 0,448 lít NO và dung dịch Y. Trong cả 2 trường hợp đều có NO là sản phẩm khử duy nhất ở kiện tiêu chuẩn. Dung dịch Y hòa tan vừa hết 2,08 gam Cu không tạo sản phẩm khử N+5. Các phản ứng đều hoàn toàn. Giá trị m là:
Hướng dẫn:
Tổng số mol khí NO sau các phản ứng là: 0,07 mol
Giả sử trong Y có Fe3+ và Fe2+
⇒ bảo toàn e: 3nFe3+ + 2nFe2+ = 3nNO
Lại có: 2Fe3+ + Cu → Cu2+ + 2Fe2+ (Y hòa tan Cu nhưng không có sản phẩm khử của N+5)
⇒ nFe3+ = 2nCu = 0,065 mol ⇒ nFe2+ = 0,0075 mol
⇒ m = 56.(0,065 + 0,0075) = 4,06g
Bài 4: Cho 6,72 gam bột Fe tác dụng với 384 ml dung dịch AgNO3 1M sau khi phản ứng kết thúc thu được dung dịch A và m gam chất rắn. Dung dịch A tác dụng được với tối đa bao nhiêu gam bột Cu?
Hướng dẫn:
nFe = 0,12 mol; nAgNO3 = 0,384 mol
Fe + 2Ag+ → Fe2+ + 2Ag
Fe2+ + Ag+ → Fe3+ + Ag
⇒ Dung dịch sau có: 0,12 mol Fe3+; 0,024 mol Ag+
⇒ 2nCu = nFe3+ + nAg+
⇒ nCu = 0,072 mol
⇒ mCu = 4,608g
--------------------------------------
Trên đây VnDoc.com vừa giới thiệu tới các bạn Lý thuyết Hóa học 12 bài 31: Sắt, mong rằng qua đây các bạn có thể học tập tốt hơn môn Hóa học nhé. Mời các bạn cùng tham khảo thêm kiến thức các môn: Toán 12, Vật lý 12, Giải bài tập Toán 12, Giải bài tập Hóa 12,...




