Lý thuyết Hóa học 12 bài 18: Tính chất của kim loại và dãy điện hóa của kim loại
Lý thuyết Hóa học 12 bài 18: Tính chất của kim loại và dãy điện hóa của kim loại được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
1. Tính chất vật lí của Kim loại
Hầu hết kim loại đều ở trạng thái rắn (trừ Hg) và có các tính chất chung sau: Tính dẻo, tính dẫn điện, tính dẫn nhiệt và tính ánh kim. Nguyên nhân: Tính chất vật lí chung của kim loại gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại.
Ngoài tính chất vật lí chung, kim loại còn có các tính chất riêng sau:
- Khối lượng riêng: Nhỏ nhất: Li (0,5g/cm3); lớn nhất Os (22,6g/cm3).
- Nhiệt độ nóng chảy: Thấp nhất : Hg (−39oC); cao nhất W (3410oC).
- Kim loại mềm nhất là K, Rb, Cs (dùng dao cắt được) và cứng nhất là Cr (có thể cắt được kính).
a. Tính dẻo
- Kim loại có tính dẻo: dễ rèn, dễ dát mỏng và dễ kéo sợi.
- Nguyên nhân: vì các ion dương trong mạng tinh thể kim loại có thể trượt lên nhau dễ dàng mà không tách rời nhau nhờ những electron tự do chuyển động dính kết chúng với nhau.
- Kim loại Au có tính dẻo cao.
b. Tính dẫn điện
-
Khi đặt một hiệu điện thế vào hai đầu dây kim loại, những electron chuyển động tự do trong kim loại sẽ chuyển động thành dòng có hướng từ cực âm đến cực dương, tạo thành dòng điện.
-
Ở nhiệt độ càng cao thì tính dẫn điện của kim loại càng giảm do ở nhiệt độ cao, các ion dương dao động mạnh cản trở dòng electron chuyển động.
-
Dãy chất có tính dẫn điện giảm dần là: Ag > Cu > Au > Al > Fe
c. Tính dẫn nhiệt
- Thường các kim loại dẫn điện tốt cũng dẫn nhiệt tốt.
d. Tính ánh kim
-
Các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được, do đó kim loại có vẻ sáng lấp lánh gọi là ánh kim.
2. Tính chất hóa học của Kim loại
Tính chất hoá học chung của kim loại là tính khử.
M → Mn+ + ne
a. Tác dụng với phi kim: (Cl2; O2; S;...)
Ví dụ: Thí nghiệm ![]() \(2Fe +3Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}\)
\(2Fe +3Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}\)
Ví dụ: Thí nghiệm phản ứng với Lưu huỳnh (S)
![]() \(Fe +S\overset{t^{0}}{\rightarrow}FeS\)
\(Fe +S\overset{t^{0}}{\rightarrow}FeS\)
b. Tác dụng với dung dịch Axit
Với dung dịch HCl, H2SO4 loãng: Nhiều kim loại có thể khử được ion H+ trong dung dịch axit thành H2
Ví dụ: Thí nghiệm Fe + 2HCl → FeCl2 + H2
Với dung dịch HNO3, H2SO4 đặc:
Ví dụ: Thí nghiệm ![]() \(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2}_{loang} + 2NO \uparrow + 4{H_2}O\)
\(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2}_{loang} + 2NO \uparrow + 4{H_2}O\)
Ví dụ: Thí nghiệm ![]() \(Cu + 2{H_2}S{O_4}_{(dac)} \to CuS{O_4} + S{O_2} \uparrow + {\rm{ }}2{H_2}O\)
\(Cu + 2{H_2}S{O_4}_{(dac)} \to CuS{O_4} + S{O_2} \uparrow + {\rm{ }}2{H_2}O\)
c. Tác dụng với nước
Các kim loại có tính khử mạnh: kim loại nhóm IA và IIA (trừ Be, Mg) khử H2O dễ dàng ở nhiệt độ thường.
Các kim loại có tính khử trung bình chỉ khử nước ở nhiệt độ cao (Fe, Zn,…).
Các kim loại còn lại không khử được H2O.
d. Tác dụng với dung dịch muối
Kim loại mạnh hơn có thể khử được ion của kim loại yếu hơn trong dung dịch muối thành kim loại tự do.
Ví dụ: Thí nghiệm ![]() \(Fe + CuS{O_4} \to FeS{O_4} + Cu \downarrow\)
\(Fe + CuS{O_4} \to FeS{O_4} + Cu \downarrow\)
3. Dãy điện hóa
a. Cặp oxi hóa - khử của kim loại
Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá – khử của kim loại.
Ví dụ: Cặp oxi hoá – khử Ag+/Ag; Cu2+/Cu; Fe2+/Fe
b. Dãy điện hóa của kim loại

Dự đoán chiều của phản ứng oxi hoá – khử theo quy tắc anpha: chất oxi hoá mạnh hơn + chất khử mạnh hơn → chất oxi hóa yếu hơn + chất khử yếu hơn.
Ví dụ: Phản ứng giữa hai cặp Fe2+/Fe và Cu2+/Cu xảy ra theo chiều ion Cu2+ oxi hoá Fe tạo ra ion Fe2+ và Cu.

Ta có: Fe + Cu2+ → Fe2+ + Cu
Tổng quát: Giả sử có 2 cặp oxi hoá – khử Xx+/X và Yy+/Y (cặp Xx+/X đứng trước cặp Yy+/Y).
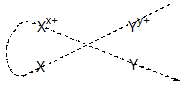
4. Bài tập minh họa
(a) Cho dung dịch AgNO3 vào dung dịch HCl
(b) Cho Al2O3 vào dung dịch HCl loãng dư
(c) Cho Cu vào dung dịch HCl đặc nóng dư
(d) Cho Ba(OH)2 vào dung dịch KHCO3
Sau khi kết thúc các phản ứng, số thí nghiệm thu được chất rắn là :
Hướng dẫn:![]() \((a) AgN{O_3} + HCl \to AgCl \downarrow + HN{O_3}\)
\((a) AgN{O_3} + HCl \to AgCl \downarrow + HN{O_3}\)
(c) Cu không phản ứng với HCl
![]() \((d) Ba{\left( {OH} \right)_2} + 2KHC{O_3} \to {K_2}C{O_3} + BaC{O_3} \downarrow + 2{H_2}O\)
\((d) Ba{\left( {OH} \right)_2} + 2KHC{O_3} \to {K_2}C{O_3} + BaC{O_3} \downarrow + 2{H_2}O\)
Cu + Ag+ tạo ra trong dung dịch là Cu2+. Cho Fe (dư) vào dung dịch chứa Cu2+ thì tạo Fe2+.
Bài 3: Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M.Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là:Hướng dẫn:
 \(\begin{array}{l} Fe{\rm{ }} + CuS{O_4} \to FeS{O_4} + C{u_ \downarrow }{\rm{ }}\\ {\rm{0,01}} \leftarrow {\rm{0,01}} \to {\rm{ 0,01}} \end{array}\)
\(\begin{array}{l} Fe{\rm{ }} + CuS{O_4} \to FeS{O_4} + C{u_ \downarrow }{\rm{ }}\\ {\rm{0,01}} \leftarrow {\rm{0,01}} \to {\rm{ 0,01}} \end{array}\)
mchất rắn = mCu + m Fe dư = 0,01.64 + (0,04-0,01).56 = 2,32 (gam)
Bài 4: Hòa tan hoàn toàn 6,5g Zn bằng dung dịch H2SO4 loãng thu được V lít H2 (đktc). Giá trị của V là:Để ý phần electron lúc cho và nhận đều bằng 2 nên ta có:
 \(\begin{array}{l} {n_{{H_2}}} = {n_{Zn}} = \frac{{6,5}}{{65}} = 0,1(mol)\\ \to {V_{{H_2}}} = 0,1.22,4 = 2,24(lit) \end{array}\)
\(\begin{array}{l} {n_{{H_2}}} = {n_{Zn}} = \frac{{6,5}}{{65}} = 0,1(mol)\\ \to {V_{{H_2}}} = 0,1.22,4 = 2,24(lit) \end{array}\)
![]() \(*Hoặc viết ptpu: Zn + {H_2}S{O_4} \to Zn{\rm{S}}{{\rm{O}}_4} + {H_2}^ \uparrow\)
\(*Hoặc viết ptpu: Zn + {H_2}S{O_4} \to Zn{\rm{S}}{{\rm{O}}_4} + {H_2}^ \uparrow\)
--------------------------------------
Trên đây VnDoc.com vừa giới thiệu tới các bạn Lý thuyết Hóa học 12 bài 18: Tính chất của kim loại và dãy điện hóa của kim loại, mong rằng qua đây các bạn có thể học tập tốt hơn môn Hóa học nhé. Mời các bạn cùng tham khảo thêm kiến thức các môn: Toán 12, Vật lý 12, Giải bài tập Toán 12, Giải bài tập Hóa 12,...