Đề kiểm tra học kì 2 môn Hóa lớp 10 năm học 2014-2015 trường THPT Lương Ngọc Quyến, Thái Nguyên
Đề kiểm tra học kì 2 môn Hóa lớp 10 năm học 2014-2015 trường THPT Lương Ngọc Quyến, Thái Nguyên là đề thi học kì II môn Hóa lớp 10 có đáp án dành cho các bạn tham khảo, ôn tập, hệ thống chương trình Hóa học, củng cố kiến thức chuẩn bị cho các kì thi quan trọng sắp tới.
Đề kiểm tra học kì 2 môn Hóa lớp 10
| SỞ GD & ĐT THÁI NGUYÊN TRƯỜNG THPT LƯƠNG NGỌC QUYẾN |
ĐỀ KIỂM TRA HỌC KÌ II NĂM HỌC 2014- 2015 Môn: HOÁ HỌC - LỚP 10 Thời gian làm bài: 45 phút, không kể thời gian phát đề |
Mã đề 209
Họ và tên học sinh:…………......……………SBD: …………....... Phòng: ………
I. PHẦN TRẮC NGHIỆM GỒM 15 CÂU TỪ CÂU 1- 15 (6 ĐIỂM)
Chú ý: Học sinh GHI MÃ ĐỀ, kẻ bảng này vào bài kiểm tra, chọn một đáp án đúng và trả lời phần trắc nghiệm theo mẫu sau:
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Đáp án |
Cho biết nguyên tử khối của các nguyên tố: H = 1; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108.
Câu 1: Cho sơ đồ phản ứng: Fe + H2SO4(đặc, nóng) → Fe2(SO4)3 + SO2 + H2O. Số phân tử H2SO4 bị khử và số phân tử H2SO4 làm môi trường trong PTHH của phản ứng trên là:
A. 6 và 6. B. 3 và 6. C. 3 và 3 D. 6 và 3.
Câu 2: Phương trình phản ứng thể hiện tính oxi hóa của SO2 là?
A. SO2 + KOH → KHSO3 B. SO2 + Cl2 + 2H2O → H2SO4 + 2HCl
C. SO2 + 2H2S → 3S + 2H2O D. SO2 + H2O → H2SO3
Câu 3: Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
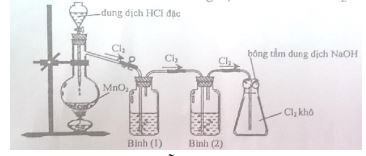
Khí Cl2 sinh ra thường lẫn hơi nước và hiđro clorua. Để thu được khí Cl2 khô thì bình (1) và bình (2) lần lượt đựng:
A. dung dịch NaOH và dung dịch H2SO4 đặc. B. dung dịch H2SO4 đặc và dung dịch NaCl.
C. dung dịch H2SO4 đặc và dung dịch AgNO3. D. dung dịch NaCl và dung dịch H2SO4 đặc.
Câu 4: Cho dung dịch H2SO4 tới dư vào BaCO3, thấy hiện tượng
A. sủi bọt khí không màu. B. có kết tủa trắng và có khí không màu.
C. có kết tủa trắng. D. không có hiện tượng gì
Câu 5: Cho V lít khí SO2 (đktc) tác dụng hết với m gam dung dịch NaOH 10% tạo ra 0,2 mol muối trung hoà và 0,1 mol muối axit. Giá trị V và m lần lượt là:
A. 6,72 lít và 200g. B. 4,48 lít và 240 g. C. 8,96 lít và 200 g. D. 6,72 lít 120 g
Câu 6: Kim loại bị thụ động trong dung dịch H2SO4 đặc, nguội là:
A. Ag và Al. B. Cu và Ag. C. Fe và Al D. Mg và Fe.
Câu 7: Trong y học đơn chất halogen nào hòa tan trong rượu etylic được dùng làm chất sát trùng?
A. I2. B. Cl2. C. F2. D. Br2
Câu 8: Sục khí clo vào dung dịch NaOH ở nhiệt độ thường, sản phẩm là:
A. NaCl, NaClO3, H2O. B. NaCl, NaClO2, H2O. C. chỉ có NaCl, H2O. D. NaCl, NaClO, H2O.
Câu 9: Có các lọ mất nhãn đựng riêng biệt các dung dịch sau: NaOH, NaCl, H2SO4, Ba(OH)2. Chỉ dùng thêm một thuốc thử nào sau đây để nhận biết tất cả các dung dịch trên?
A. BaCl2. B. Quỳ tím. C. AgNO3. D. KOH.
Câu 10: Đổ dung dịch chứa 30 gam HCl 30% vào dung dịch chứa 60g dung dịch NaOH 15%. Nhúng quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu
A. không đổi màu. B. không xác định được.
C. màu xanh. D. màu đỏ.
Câu 11: Hoà tan 1,44 g một kim loại hoá trị II trong 150 ml dung dịch H2SO4 0,5M. Để trung hoà axit dư trong dung dịch thu được, phải dùng hết 30 ml dung dịch NaOH 1M. Kim loại đó là:
A. Ba. B. Ca. C. Mg. D. Be
Câu 12: Dung dịch axit sunfuric loãng có thể tác dụng với dãy chất nào sau đây?
A. Zn, NaOH, Na2SO4. B. CO2, K2CO3,C.
C. Fe, Cu(OH)2, Na2CO3. D. Cu, Mg(OH)2, CaCO3.
Câu 13: Ứng dụng nào sau đây không phải của ozon?
A. Tẩy trắng tinh bột, dầu ăn. B. Chữa sâu răng.
C. Điều chế oxi trong phòng thí nghiệm. D. Sát trùng nước sinh hoạt
Câu 14: Các nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng là:
A. ns²np5. B. ns²np6. C. ns²np4. D. ns²np³.
Câu 15: Chất nào sau đây có thể được làm khô bằng H2SO4 đặc?
A. SO2. B. O2. C. H2S. D. HBr
II. PHẦN TỰ LUẬN (4 ĐIỂM)
Câu 1: (1,5 điểm)
Hoàn thành các phương trình hoá học sau(ghi rõ điều kiện nếu có):
FeS2 → SO2 → SO3 → H2SO4 → KHSO4 → K2SO4
Câu 2: (2,5 điểm)
Khi hoà tan 14,7 gam hỗn hợp gồm Al, Cu, Mg vào dung dịch HCl dư thấy giải phóng 5,6 lít khí H2 (đktc). Phần không tan cho tác dụng với axit H2SO4 đặc, nóng thấy giải phóng 3,36 lít khí SO2 (đktc).
a. Viết các phương trình hóa học xảy ra.
b. Tính khối lượng mỗi kim loại trong hỗn hợp đầu.
c. Sục lượng khí SO2 nói trên vào 400 ml dung dịch NaOH 0,5 M. Tính khối lượng muối tạo thành.
----------- HẾT ----------
Đáp án đề kiểm tra học kì 2 môn Hóa lớp 10
I. Phần trắc nghiệm
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Đáp án | C | C | D | B | A | C | A | D | B | D | C | C | C | A | B |
II. Phần Tự luận
Câu 1:
Hoàn thành các phương trình hóa học sau:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2 → 2SO3 (có xúc tác, to)
SO3 + H2O → H2SO4
H2SO4 + KOH → KHSO4 + H2O
KHSO4+ KOH → K2SO4 + H2O
Câu 2:
a. Phương trình phản ứng:
2Al + 6HCl → 2 AlCl3 + 3H2 (1)
x 3/2x
Mg + 2HCl → MgCl2 + H2 (2)
y y
Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2 + H2O (3)
0,15 mol 0,15 mol
b. Theo (3): ncu = n SO2= 0,15 (mol) → mCu = 0,15 × 64= 9,6 (g).
mAl, Mg = 14,7- 9,6 = 5,1 (g)
Gọi số mol Al là x, Cu là y, ta có: 27 x+ 24 y = 5,1 (I)
Theo pt (1), (2) và số mol H2 ta có: x + y = 0,25 (mol) (II)
Từ (I), (II) ta có x = y = 0,1. Vậy: mAl = 0,1 × 27 = 2,7 g
mMg = 0,1 × 24 = 2,4 g
c. (1 điểm) ta có: nNaOH : nSO2 = 0,2 : 0,15 = 1,33 => 2 muối
SO2 + NaOH → NaHSO3 (4)
a mol a mol a mol
SO2 + 2NaOH → Na2SO3 +H2O (5)
b mol 2b mol b mol
Ta có:
- a + b = 0,15
- a + 2b = 0,2
=> a = 0,1 (mol); b = 0,05 (mol)
Khối lượng muối thu được là: 0,1.104 + 0,05.126 = 16,7 gam.




