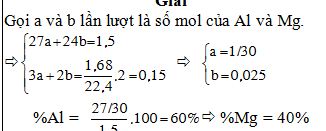Giáo án Hóa học lớp 12 bài 22: Luyện tập tính chất của kim loại
Giáo án môn Hóa học lớp 12
Giáo án Hóa học lớp 12 bài 22: Luyện tập tính chất của kim loại được VnDoc sưu tầm và giới thiệu để có thể chuẩn bị giáo án và bài giảng hiệu quả, giúp quý thầy cô tiết kiệm thời gian và công sức làm việc. Giáo án môn Hóa học 12 này được soạn phù hợp quy định Bộ Giáo dục và nội dung súc tích giúp học sinh dễ dàng hiểu bài học hơn.
Giáo án Hóa học lớp 12 bài: Ôn tập học kì 1
Giáo án Hóa học lớp 12 bài 21: Điều chế kim loại
Giáo án Hóa học lớp 12 bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại
I. MỤC TIÊU BÀI HỌC
1. Kiến thức: Hệ thống hoá về kiến thức của kim loại qua một số bài tập lí thuyết và tính toán.
2. Kỹ năng: Giải được các bài tập liên quan đến tính chất của kim loại.
Trọng tâm: Giải được các bài tập liên quan đến tính chất của kim loại.
3. Tư tưởng:Kiên trì, cẩn thận khi giải BT hóa
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên: Giáo án, hệ thống câu hỏi và bài tập
2. Học sinh: Làm BT và đọc trước bài mới trước khi đến lớp
III. PHƯƠNG PHÁP
Kết hợp khéo léo giữa đàm thoại, nêu vấn đề và hoạt động nhóm
IV. TIẾN TRÌNH BÀI GIẢNG
1. Ổn định tổ chức:
2. Kiểm tra bài cũ: Trong giờ học
3. Bài mới:
|
Hoạt động của Giáo viên và Học sinh |
Nội dung ghi bảng |
|
* Hoạt động 1: - GV: Chia lớp thành 3 nhóm và thảo luận 3 nội dung ở phần I. Gọi đại diện nhóm lên trình bày. HS: Thảo luận và lên bảng trình bày - GV: Nhận xét và bổ sung HS: Nghe TT |
I. KIẾN THỨC CẦN NHỚ 1. Cấu tạo của kim loại: (SGK-99) 2. Tính chất của kim loại: (SGK-99) 3. Dãy điện hóa của kim loại: - Dãy điện hóa: Bảng tuần hoàn - Ứng dụng: Xác định chiều của pư theo quy tắc alpha: (SGK-100) |
|
* Hoạt động 2: BTTN - GV: Trước tiên các em làm BTTN HS: vận dụng tính chất hoá học chung của kim loại để giải quyết bài tập. |
II. BÀI TẬP Bài 1: Dãy các kim loại đều phản ứng với H2O ở nhiệt độ thường là: A. Fe, Zn, Li, Sn B. Cu, Pb, Rb, Ag C. K, Na, Ca, Ba D. Al, Hg, Cs, Sr |
|
- GVHD: Vận dụng phương pháp tăng giảm khối lượng (nhanh nhất). Fe + CuCl2 → FeCl2 + Cu 56g ←1mol→ 64g ð tăng 8g 0,1 mol ð tăng 0,8g. HS: Làm BT theo HD của GV |
Bài 2: Ngâm một đinh sắt trong 100 ml dung dịch CuCl2 1M, giả sử Cu tạo ra bám hết vào đinh sắt. Sau khi phản ứng xong, lấy đinh sắt ra, sấy khô, khối lượng đinh sắt tăng thêm A. 15,5g B. 0,8g C. 2,7g D. 2,4g |
|
- GVHD: Bài này chỉ cần cân bằng sự tương quan giữa kim loại R và NO 3R → 2NO 0,075 ←0,05 ð R = 4,8/0,075 = 64 HS: Làm BT theo HD của GV |
Bài 3: Cho 4,8g kim loại R hoá trị II tan hoàn toàn trong dung dịch HNO3 loãng thu được 1,12 lít NO duy nhất (đkc). Kim loại R là: A. Zn B. Mg C. Fe D. Cu |
|
- GVHD: Tương tự bài 3, cân bằng sự tương quan giữa Cu và NO2 Cu → 2NO2 HS: Làm BT theo HD của GV |
Bài 4: Cho 3,2g Cu tác dụng với dung dịch HNO3 đặc, dư thì thể tích khí NO2 thu được (đkc) là A. 1,12 lít B. 2,24 lít C. 3,36 lít D. 4,48 lít |
|
- GVHD: Fe và FeS tác dụng với HCl đều cho cùng một số mol khí nên thể tích khí thu được xem như chỉ do một mình lượng Fe ban đầu phản ứng. Fe → H 2 ð nH2 = nFe = 16,8/56 = 0,3 ð V = 6,72 lít HS: Làm BT theo HD của GV |
Bài 5: Nung nóng 16,8g Fe với 6,4g bột S (không có không khí) thu được sản phẩm X. Cho X tác dụng với dung dịch HCl dư thì có V lít khí thoát ra (đkc). Các phản ứng xảy ra hoàn toàn. Giá trị V là A. 2,24 lít B. 4,48 lít C. 6,72 lít D. 3,36 lít |
|
- GVHD: nhh oxit = nH2 = nhh kim loại = 0,1 (mol) Khi hỗn hợp kim loại tác dụng với dung dịch HCl thì: nH2 = nhh kim loại = 0,1 (mol) ð V = 2,24 lít HS: Làm BT theo HD của GV |
Bài 6: Để khử hoàn toàn hỗn hợp gồm FeO và ZnO thành kim loại cần 2,24 lít H2 (đkc). Nếu đem hết hỗn hợp thu được cho tác dụng với dung dịch HCl thì thể tích khí H2 thu được (đkc) là A. 4,48 lít B. 1,12 lít C. 3,36 lít D. 2,24 lít |
|
- GVHD: Tính số mol CuO tạo thành ð nHCl = nCuO ð kết quả HS: Làm BT theo HD của GV |
Bài 7: Cho 6,72 lít H2 (đkc) đi qua ống sứ đựng 32g CuO đun nóng thu được chất rắn A. Thể tích dung dịch HCl đủ để tác dụng hết với A là A. 0,2 lít B. 0,1 lít C. 0,3 lít D. 0,01 lít |
|
* Hoạt động 3: BT TỰ LUẬN - GVHD: Vận dụng quy luật phản ứng giữa kim loại và dung dịch muối để biết trường hợp nào xảy ra phản ứng và viết PTHH của phản ứng.
HS: Lên bảng viết pt pư - GV: lưu ý đến phản ứng của Fe với dung dịch AgNO3, trong trường hợp AgNO3 thì tiếp tục xảy ra phản ứng giữa dung dịch muối Fe2+ và dung dịch muối Ag+. HS: Nghe và ghi TT |
Bài 8: Cho một lá sắt nhỏ vào dung dịch chứa một trong những muối sau: CuSO4, AlCl3, Pb(NO3)2, ZnCl2, KNO3, AgNO3. Viết PTHH dạng phân tử và ion rút gọn của các phản ứng xảy ra (nếu có). Cho biết vai trò của các chất tham gia phản ứng. Giải Fe + CuSO4 → FeSO4 + Cu Fe + Cu2+ → Fe2+ + Cu↓ Fe + Pb(NO3)2 → Fe(NO3)2 + Pb↓ Fe + Pb2+ → Fe2+ + Pb↓ Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓ Fe + 2Ag+ → Fe2+ + 2Ag↓ Nếu AgNO3 dư thì: Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓ Fe2+ + Ag+ → Fe3+ + Ag↓
|
|
- GVHD: Cách làm nhanh nhất là vận dụng phương pháp bảo toàn electron. HS: Làm BT theo HD của GV |
Bài 9: Hoà tan hoàn toàn 1,5g hỗn hợp bột Al và Mg vào dung dịch HCl thu được 1,68 lít H2 (đkc). Tính % khối lượng mỗi kim loại trong hỗn hợp. Giải
|
4. Củng cố bài giảng:
Câu 1. Đốt cháy hết 1,08g một kim loại hoá trị III trong khí Cl2 thu được 5,34g muối clorua của kim loại đó. Xác định kim loại.
Câu 2. Khối lượng thanh Zn thay đổi như thế nào sau khi ngâm một thời gian trong các dung dịch:
a) CuCl2 b) Pb(NO3)2 c) AgNO3 d) NiSO4
Câu 3. Cho 8,85g hỗn hợp Mg, Cu và Zn vào lượng dư dung dịch HCl thu được 3,36 lít H2 (đkc). Phần chất rắn không tan trong axit được rửa sạch rồi đốt trong khí O2 thu được 4g chất bột màu đen.
Tính % khối lượng mỗi kim loại trong hỗn hợp.
5. Bài tập về nhà:
* Các bài tập còn lại trong SGK - 100, 101