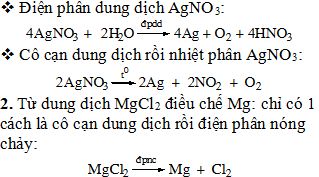Giáo án Hóa học lớp 12 bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại
Giáo án môn Hóa học lớp 12
Giáo án Hóa học lớp 12 bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại được VnDoc sưu tầm và giới thiệu để có thể chuẩn bị giáo án và bài giảng hiệu quả, giúp quý thầy cô tiết kiệm thời gian và công sức làm việc. Giáo án môn Hóa học 12 này được soạn phù hợp quy định Bộ Giáo dục và nội dung súc tích giúp học sinh dễ dàng hiểu bài học hơn.
Giáo án Hóa học lớp 12 bài 21: Điều chế kim loại
Giáo án Hóa học lớp 12 bài 22: Luyện tập tính chất của kim loại
Giáo án Hóa học lớp 12 bài 24: Thực hành tính chất, điều chế kim loại và sự ăn mòn kim loại
I. MỤC TIÊU BÀI HỌC
1. Kiến thức: Củng cố kiến thức về nguyên tắc điều chế kim loại và các phương pháp điều chế kim loại
2. Kỹ năng: Kĩ năng tính toán lượng kim loại điều chế theo các phương pháp hoặc các đại lượng có liên quan
Trọng tâm: Giải các BT liên quan đến điều chế kim loại.
3. Tư tưởng:Tích cực, chủ động trong học tập
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên: Giáo án, hệ thống câu hỏi và BT
2. Học sinh: Đọc bài mới trước khi đến lớp
III. PHƯƠNG PHÁP
Kết hợp khéo léo giữa đàm thoại, nêu vấn đề và hoạt động nhóm
IV. TIẾN TRÌNH BÀI GIẢNG
Tiết 39
1. Ổn định tổ chức:
2. Kiểm tra bài cũ: Trong giờ học
3. Bài mới:
|
Hoạt động của Giáo viên và Học sinh |
Nội dung ghi bảng |
|
* Hoạt động 1: - GV: đặt hệ thống câu hỏi: + Có mấy PP đ/c KL, nêu nguyên tắc và phạm vi áp dụng của từng pp? + Ăn mòn KL là gì? + Có mấy dạng ăn mòn KL? + Nêu các cách phòng chống ăn mòn KL? HS: Thảo luận và trả lời - GV: Nhận xét và bổ sung HS: Nghe TT |
I . KIẾN THỨC CẦN NHỚ 1. Điều chế kim loại: (SGK-102) 2. Sự ăn mòn kim loại: (SGK-102) |
|
* Hoạt động 2: - GV: Treo bảng phụ ghi ND BT1/103 lên bảng và yêu cầu HS làm BT HS: Làm BT theo HD của GV và lên bảng trình bày
- GV: Gọi HS khác nhận xét HS: Nghe TT
- GV: Nhận xét và bổ sung HS: Nghe TT |
II . BÀI TẬP * Bài 1/103: Bằng những phương pháp nào có thể điều chế được Ag từ dung dịch AgNO3, điều chế Mg từ dung dịch MgCl2? Viết các phương trình hoá học. Giải 1. Từ dung dịch AgNO3 điều chế Ag. Có 3 cách: v Dùng kim loại có tính khử mạnh hơn để khử ion Ag+. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
|
|
* Hoạt động 3: - GV: Treo bảng phụ ghi ND BT2/103 lên bảng và yêu cầu HS làm BT HS: Làm BT theo HD của GV và lên bảng trình bày
- GV: Lưu ý: mvật sau phản ứng = mCu(bđ) – mCu(phản ứng) + mAg(bám vào) HS: Nghe TT
- GV: Nhận xét và bổ sung HS: Nghe TT
|
* Bài 2/103: Ngâm một vật bằng đồng có khối lượng 10g trong 250g dung dịch AgNO3 4%. Khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%. a) Viết phương trình hoá học của phản ứng và cho biết vai trò của các chất tham gia phản ứng. b) Xác định khối lượng của vật sau phản ứng. Giải a) PTHH Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓ b) Xác định khối lượng của vật sau phản ứng Khối lượng AgNO3 có trong 250g dd: (250/100).4 = 10 (g) Số mol AgNO3 tham gia phản ứng là: 10.17/100.170 = 0,01 (mol) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓ mol: 0,005 ←0,01→ 0,01 Khối lượng vật sau phản ứng là: 10 + (108.0,01) – (64.0,005+ = 10,76 (g) |
|
* Hoạt động 4: - GV: Treo bảng phụ ghi ND BT3 lên bảng và yêu cầu HS làm BT HS: Làm BT theo HD của GV và lên bảng trình bày - GV: Gọi HS khác nhận xét HS: Nghe TT - GV: Nhận xét và bổ sung HS: Nghe TT |
* Bài 3: Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3 và MgO (đun nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm: A. Cu, Al, Mg B. Cu, Al, MgO C. Cu, Al2O3, Mg D. Cu, Al2O3, MgOP
|
4. Củng cố bài giảng: Bài 3/103-SGK
5. Bài tập về nhà: Bài tập 4 và bài tập 5 - SGK/103