Hóa học 10 bài 2: Hạt nhân nguyên tử nguyên tố hóa học đồng vị
Chúng tôi xin trân trọng giới thiệu bài Lý thuyết Hóa học lớp 10 bài 2: Hạt nhân nguyên tử nguyên tố hóa học đồng vị được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Hóa học lớp 10. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết
Bài: Hạt nhân nguyên tử nguyên tố hóa học đồng vị
A/ Lý thuyết Hóa học 10 bài 2
I. Hạt nhân nguyên tử
1. Điện tích hạt nhân
a) Proton mang điện tích 1+
- Nếu hạt nhân có Z proton
⇒ Điện tích hạt nhân bằng Z+.
⇒ Số đơn vị điện tích hạt nhân bằng Z.
- Ví dụ: Oxi có 8 proton
⇒ Điện tích hạt nhân oxi là 8+.
⇒ Số đơn vị điện tích hạt nhân oxi là 8.
b) Nguyên tử trung hòa về điện: số proton bằng số electron
⇒Z = số proton = số electron
- Ví dụ: Nguyên tử nitơ có số đơn vị điện tích hạt nhân là 7
⇒ Nguyên tử nitơ có 7 proton và 7 electron.
2. Số khối
a) Số khối hạt nhân (A) bằng tổng của tổng số hạt proton (Z) và tổng số hạt nơtron (N)
- Công thức: A=Z+N
- Ví dụ: Hạt nhân nguyên tử Liti có 3 proton và 4 nơtron
⇒ ALiti = 3+4 = 7
b) Số đơn vị điện tích hạt nhân Z và số khối A đặc trưng cơ bản cho hạt nhân và nguyên tử
- Khi biết Z và A của một nguyên tử:
⇒ Số proton, số electron, số nơtron (N=A−Z) của nguyên tử đó.
- Ví dụ: Nguyên tử Na có A=23 và Z=11
⇒ Na có 11 proton, 11 electron, 12 nơtron.
II. Nguyên tố hóa học
1. Định nghĩa
- Nguyên tố hóa học gồm những nguyên tử có cùng điện tích hạt nhân (Z) nhưng khác số khối (A).
- Ví dụ: Tất cả các nguyên tử có Z=6 đều thuộc nguyên tố cacbon.
⇒ Các nguyên tử cacbon đều có 6 proton và 6 electron.
⇒ Những nguyên tử có cùng điện tích hạt nhân thì có cùng tính chất hóa học.
2. Số hiệu nguyên tử (Z)
- Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử của nguyên tố đó, kí hiệu là Z.
⇒ Số hiệu nguyên tử = Số đơn vị điện tích hạt nhân = Số proton = Số electron = Z
3. Kí hiệu nguyên tử
- Nguyên tố X có số khối A và số hiệu Z được kí hiệu như sau:AZX
⟶ X: Kí hiệu hóa học
⟶ A: Số khối nguyên tử
⟶ Z: Số hiệu nguyên tử
- Ví dụ: 2311Na
⟶ Số hiệu nguyên tử Na = Số đơn vị điện tích hạt nhân = Số proton = Số electron = Z = 11
⟶ Số khối nguyên tử ANa=23 ⇒ Số nơtron NNa=23−11=12N
III. Đồng vị
- Đồng vị là những nguyên tử có cùng số proton nhưng khác số nơtron, do đó số khối của chúng khác nhau.
- Ví dụ:
+ Hiđro có 3 đồng vị là: 11H, 21H, 31H
+ Clo có 2 đồng vị là: 3517Cl, 3717Cl
IV. Nguyên tử khối và nguyên tử khối trung bình của các nguyên tố hóa học
1. Nguyên tử khối (A)
- Nguyên tử khối là khối lượng tương đối của nguyên tử: cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
- Do khối lượng của e quá nhỏ nên nguyên tử khối coi như bằng số khối A.
Nguyên tử khối = mp + mn = A
- Ví dụ: Nguyên tử P có Z=15 và N=16 ⇒ Nguyên tử khối của P là 31
2. Nguyên tử khối trung bình (A¯)
- Do một nguyên tố thường có nhiều đồng vị nên nguyên tử khối của nguyên tố này là nguyên tử khối trung bình của các đồng vị đó.
- Công thức:
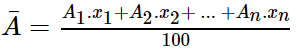
⟶ A1,A2,…An: Nguyên tử khối của các đồng vị
⟶ x1,x2,…xn: Phần trăm số nguyên tử của các đồng vị
- Ví dụ: Nguyên tố Clo có 2 đồng vị là ![]() Nguyên tử khối trung bình của Clo là:
Nguyên tử khối trung bình của Clo là:
![]()
B/ Trắc nghiệm Hóa học 10 bài 2
Câu 1: Các đồng vị của một nguyên tố hóa học được phân biệt với nhau bởi đại lượng nào sau đây?
A. Số notron
B. Số proton
C. Số e hóa trị
D. Số lớp e
Câu 2: Hai nguyên tử C và B có cùng
A. số proton.
B. số nơtron.
C. tính chất vật lý.
D. tính chất hóa học.
Câu 3: Nguyên tử X, Y, Z có kí hiệu nguyên tử lần lượt là: ![]() . Vậy X, Y, Z là:
. Vậy X, Y, Z là:
A. Ba nguyên tử có cùng số notron
B. Ba đồng vị của cùng một nguyên tố
C. Ba nguyên tố có cùng số khối
D. Ba đồng vị của ba nguyên tố khác nhau
Câu 4: Nguyên tử khối trung bình của antimon là 121,76u. Antimon có 2 đồng vị, đồng vị 12151Sb chiếm 62%. Số khối của đồng vị thứ hai là bao nhiêu? (coi nguyên tử khối bằng số khối)
A. 121u
B. 122u
C. 122,76u
D. 123u
Câu 5: Có những phát biểu sau đây về các đồng vị của cùng một nguyên tố hóa học:
1. Các đồng vị có tính chất hóa học giống nhau.
2. Các đồng vị có tính chất vật lí khác nhau.
3. Các đồng vị có cùng số electron ở vỏ nguyên tử.
4. Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 6: Hãy cho biết những đồng vị nào sau đây của R thì đồng vị nào phù hợp với tỉ lệ: số proton/số notron= 7/8?
A. 57R B. 58R C. 59R D. 60R
Câu 7: Phát biểu nào dưới đây không đúng cho 20682Pb?
A. Số khối là 206
B. Hiệu số proton và notron là 124
C. Số notron là 124
D. Số điện tích hạt nhân là 82
Câu 8: Nguyên tử của nguyên tố A có 56 electron, trong hạt nhân có 81 nơtron. Kí hiệu của nguyên tử nguyên tố A là
A. 56137A B. 13756A C. 5681A D. 8156A
Câu 9: Tổng số hạt (p,n, e) trong hai nguyên tử của nguyên tố X và Y là 96, trong đó, tổng số hạt mang điện tích nhiều hơn tổng số hạt không mang điện là 32. Số hạt mang điện của nguyên tử Y nhiều hơn của X là 16. X và Y lần lượt là:
A. Mg và Ca
B. Al và Mg
C. Fe và Mg
D. Kết quả khác
Câu 10: Nguyên tử nguyên tố Y có tổng số hạt cơ bản là 52, trong đó số hạt không mang điện trong hạt nhân lớn gấp 1,059 lần số hạt mang điện dương. Kết luận nào dưới đây là không đúng với Y?
A. Y có số khối bằng 35
B. Trạng thái cơ bản Y có 3 eletron độc thân
C. Y là nguyên tố phi kim
D. Điện tích hạt nhân của Y là 17+
Câu 11: Các hạt X, Y, Z có thành phần cấu tạo như sau:
|
Hạt |
Số electron |
Số notron |
Số proton |
|
X |
18 |
22 |
18 |
|
Y |
18 |
20 |
19 |
|
Z |
18 |
18 |
17 |
Phát biểu nào sau đây là đúng?
A. X và Z là các hạt của cùng một nguyên tố hóa học.
B. Các hạt Y và Z có cùng số khối.
C. X là hạt trung hòa về điện, còn Y là hạt tích điện dương.
D. Hạt Z tích điện dương.
Câu 12: Nguyên tố clo trong tự nhiên là một hỗn hợp hai đồng vị 3517Cl (75%), 3717X. Phần trăm về khối lượng của 3517Cl trong muối kaliclorat KClO3 là:
A. 28,95%
B. 7,24%
C. 25,6%
D. Kết quả khác
Câu 13: Biết oxi có ba đông vị là 168O, 178O, 188O với % các đồng vị tương ứng là x1, x2 và x3. Mặt khác x1= 15x2 và x1- x2= 21x3. Nguyên tử khối trung bình của oxi là:
A. 15,5 B. 15,7 C. 16,0 D. 16,14
Câu 14: Agon có 3 đồng vị với hàm lượng phần trăm số nguyên tử tương ứng là 36Ar (0,337%); 38Ar (0,063%) và 40Ar (99,6%). Nếu lấy nguyên tử bằng số khối thì thể tích của 3,6 gam agon (ở đktc) bằng bao nhiêu?
A. 1,106 lít
B. 0,3018 lít
C. 2,016 lít
D. 2,24 lít
Câu 15: Cặp nào sau đây không có sự phù hợp giữa đồng vị phóng xạ và ứng dụng thực tiễn của nó?
|
|
Đồng vị phóng xạ |
Ứng dụng |
|
A |
235U |
Sản xuất điện tích hạt nhân |
|
B |
60Co |
Tiêu diệt tế bào ung thư |
|
C |
14C |
Xác định tuổi của các hóa thạch |
|
D |
23Na |
Phát hiện vết rạn nứt trong đường ống |
Câu 16: Nguyên tử nguyên tố R có tổng số hạt mang điện và hạt không mang điện là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện. R là nguyên tử nào dưới đây?
A. Ne B. F C. Mg D. Na
Câu 17: Cho hợp chất X có công thức là MxRy trong đó M chiếm 52,94% về khối lượng. Biết x+y=5. Trong nguyên tử M số notron nhiều hơn số proton là 1. Trong nguyên tử R số notron bằng số proton. Tổng số hạt proton, notron và electron trong X là 152. X là:
A. Al2O3 B. Fe2O3 C. N2O D. P2O5
Câu 18: Trong tự nhiên, một nguyên tử 86222Ra tự động phân rã ra một hạt nhân nguyên tử 24He và một hạt nhân nguyên tử X. X là
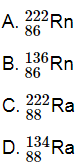
Câu 19: Khi dung hạt 2048Ca bắn vào hạt nhân 95243Am thì thu được một hạt nhân siêu nặng, đồng thời có 3 nơtron bị tách ra. Cấu tạo hạt nhân nguyên tố siêu nặng này gồm
A. 176n và 115p.
B. 173n và 115p.
C. 115n và 176p.
D. 115n và 173p.
Câu 20: Trong tự nhiên, oxi có 3 đồng vị là 16O, 17O, 18O. Có bao nhiêu loại phân tử O2?
A. 3 .B. 6. C. 9. D. 12.
Câu 21: Trong tự nhiên hidro chủ yếu tồn tại 2 đồng vị 11H và 12H (còn gọi là đơteri, kí hiệu là D). Nước tự nhiên tồn tại dạng nước bán nặng (HOD) và nước thường (H2O). Để tách được 1 gam nước bán nặng cần lấy bao nhiêu gam nước tự nhiên? Cho biết nguyên tử khối của oxi là 16, nguyên tử khối của hidro là 1,008.
A. 17,86 gam.
B. 55,55 gam.
C. 125,05 gam.
D. 118,55 gam.
Câu 22: Trong tự nhiên, X có hai đồng vị 1735X và 1737X, chiếm lần lượt 75,77% và 24,23% số nguyên tử X. Y có hai đông vị à 11Y và 12Y, chiếm lần lượt 99,2% và 0,8% số nguyên tử Y. Trong tự nhiên có bao nhiêu loại phân tử XY?
A. 2
B. 4
C. 5
D. 6
Câu 23: Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại X và Y là 142, trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 42. Số hạt mang điện của nguyên tử Y nhiều hơn của X là 12. Hai kim loại X, Y lần lượt là
A. Na, K.
B. K, Ca.
C. Mg, Fe.
D. Ca, Fe.
Câu 24: Cho các phát biểu sau:
(1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và notron.
(2). Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3). Trong nguyên tử số electron bằng số proton.
(4). Trong hạt nhân nguyên tử hạt mang điện là proton và electron.
(5). Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1 B. 2 C. 3 D. 4
Câu 25: Nguyên tố Bo (nguyên tử khối trung bình là 10,81) có hai đồng vị 10B và 11B. Phần trăm số nguyên tử mỗi đồng vị lần lượt là (coi nguyên tử khối bằng số khối)
A. 70% và 30%
B. 45% và 55%
C. 19% và 81%
D. 30% và 70%
Đáp án
| 1-A | 2-B | 3-B | 4-D | 5-D | 6-D | 7-B | 8-A | 9-A | 10-B |
| 11 | 12-B | 13-D | 14-C | 15-D | 16-D | 17-A | 18-A | 19-B | 20-B |
| 21-D | 22 | 23-D | 24 | 25-C |
-----------------------------------------
Với nội dung bài Hóa học 10 bài 2: Hạt nhân nguyên tử nguyên tố hóa học đồng vị các bạn học sinh cùng quý thầy cô cần nắm vững kiến thức về khái niệm, đặc điểm và tính chất của các hạt nhân nguyên tử các nguyên tố hóa học đồng vị..
Như vậy VnDoc đã giới thiệu các bạn tài liệu Lý thuyết Hóa học lớp 10 bài 2: Hạt nhân nguyên tử nguyên tố hóa học đồng vị. Mời các bạn tham khảo thêm tài liệu: Trắc nghiệm Sinh học 10, Giải bài tập Sinh học lớp 10, Giải Vở BT Sinh Học 10, Giải bài tập Sinh học 10 ngắn nhất, Tài liệu học tập lớp 10.
Để tiện trao đổi, chia sẻ kinh nghiệm về giảng dạy và học tập các môn học lớp 10, VnDoc mời các thầy cô giáo, các bậc phụ huynh và các bạn học sinh truy cập nhóm riêng dành cho lớp 10 sau: Nhóm Tài liệu học tập lớp 10. Rất mong nhận được sự ủng hộ của các thầy cô và các bạn.








