Hóa học 11 Cánh Diều bài 9
Theo lộ trình thực hiện Chương trình giáo dục phổ thông 2018 của Bộ Giáo dục và Đào tạo, từ năm học 2023-2024, học sinh các khối lớp 11 sẽ học theo chương trình, sách giáo khoa mới. Để giúp các thầy cô và các em học sinh làm quen với từng bộ sách mới, VnDoc xin giới thiệu tài liệu Hóa học 11 Cánh Diều bài 9. Mời quý bạn đọc cùng tham khảo.
Hóa học 11 Cánh Diều bài 9: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
Mở đầu trang 57 Hoá học 11
Để tách và tinh chế một chất từ hỗn hợp của chất đó với những chất khác, cần sử dụng các phương pháp khác nhau. Theo em:
a) Làm thế nào để thu được ethyl alcohol từ hỗn hợp tạo thành sau khi lên men tinh bột?
b) Làm thế nào để thu được đường saccharose (sucrose) từ nước ép mía?
Lời giải:
a) Để thu được ethyl alcohol từ hỗn hợp tạo thành sau khi lên men tinh bột sử dụng phương pháp chưng cất;
b) Để thu được đường saccharose (sucrose) từ nước ép mía dùng phương pháp kết tinh và lọc.
I. Phương pháp kết tinh
Câu hỏi 1 trang 57 Hoá học 11
Độ tan trong nước của monosodium glutamate (mì chính hay bột ngọt) ở 60 oC là 112 g/ 100 g nước; ở 25 oC là 74 g/ 100 g nước. Tính khối lượng monosodium glutamate kết tinh khi làm nguội 212 g dung dịch monosodium glutamate bão hoà ở 60 oC xuống 25 oC.
Lời giải:
Khối lượng monosodium glutamate có trong 212 g dung dịch bão hoà ở 60 oC là:
![]() \(m_{1}=\frac{212.112}{(100+112)}=112(gam)\)
\(m_{1}=\frac{212.112}{(100+112)}=112(gam)\)
Khối lượng monosodium glutamate có trong 212 g dung dịch bão hoà ở 25oC là:
![]() \(m_{2}=\frac{212.74}{(74+100)}\approx 90,16(gam)\)
\(m_{2}=\frac{212.74}{(74+100)}\approx 90,16(gam)\)
Khối lượng monosodium glutamate kết tinh khi làm nguội 212 g dung dịch monosodium glutamate bão hoà ở 60 oC xuống 25 oC là:
112 – 90,16 = 21,84 (gam).
II. Phương pháp chiết
Vận dụng trang 58 Hoá học 11: Để có được một số hoạt chất từ thảo dược sử dụng để bồi bổ cơ thể hoặc chữa bệnh, người ta có thể lấy thảo dược đem “sắc thuốc” hoặc “ngâm rượu thuốc”. Phương pháp nào đã được sử dụng để thu được hoạt chất trong các trường hợp này? Vì sao khi ngâm "rượu thuốc" không cần đun nóng, nhưng khi "sắc thuốc" cần đun nóng thảo dược trong nước?
Lời giải:
Hoạt chất từ thảo dược được sử dụng để bồi bổ cơ thể hoặc chữa bệnh thường là các chất hữu cơ. Các chất hữu cơ thường tan tốt trong dung môi rượu (ethanol) và “rượu thuốc” thường ngâm trong thời gian dài, do đó khi ngâm “rượu thuốc” không cần đun nóng. Ngoài ra, nhiệt độ sôi của rượu thấp 78,3 oC nếu đun quá nóng lại làm giảm độ rượu.
Ngược lại, khi “sắc thuốc” cần đun nóng thảo dược trong nước do các chất hữu cơ (hoạt chất từ thảo dược) thường không tan trong nước ở điều kiện thường, nhưng có thể bay hơi cùng với nước khi đun nóng (do đó khi sắc thuốc thường nút kín ấm để giữ hoạt chất). Ngoài ra, thời gian sử dụng thuốc sắc ngắn hơn so với thuốc ngâm rượu.
Câu hỏi 2 trang 58 Hoá học 11: Nước ép mía là dung dịch chưa bão hoà với thành phần chất tan chủ yếu là đường (còn gọi là đường kính, saccharose). Cần sử dụng phương pháp nào để thu được đường kính từ nước mía?
Lời giải:
Sơ đồ sản xuất đường kính từ nước ép mía:

Như vậy để thu được đường kính từ nước mía, cần sử dụng phương pháp kết tinh và phương pháp lọc.
Thí nghiệm 1 trang 59 Hoá học 11
Chiết tinh dầu
Chuẩn bị: Hỗn hợp tinh dầu (tinh dầu sả, tinh dầu tràm, tinh dầu bưởi,...) và nước, hexane, phễu chiết, bình tam giác, phễu thuỷ tinh, đũa thuỷ tinh, giá thí nghiệm (bao gồm vòng đỡ phễu chiết).
Tiến hành: Cho khoảng 30 mL hỗn hợp tinh dầu lẫn nước vào phễu chiết 60 mL, thêm tiếp khoảng 15 mL hexane. Đây nắp phễu chiết, lắc đều rồi để phễu chiết lên giá, mở nắp phễu chiết rồi đậy lại ngay. Sau khi để yên khoảng 5 phút, mở nắp phễu chiết rồi mở khoá phễu chiết. Khi toàn bộ lớp chất lỏng phía dưới (lớp nước) chảy xuống bình hứng thì khoá phễu chiết và thu lấy lớp chất lỏng ở phía trên.
Yêu cầu: Tách được tinh dầu. Cho biết vai trò của hexane trong thí nghiệm trên.
Lời giải:
Học sinh tự làm thí nghiệm.
Vai trò của hexane trong thí nghiệm: dung môi chiết.
III. Phương pháp chưng cất
Luyện tập trang 59 Hoá học 11
Trình bày phương pháp:
a) Thu lấy rượu (dung dịch ethyl alcohol) có lẫn trong cơm rượu sau khi lên men.
b) Thu lấy tinh dầu cam từ vỏ cam.
Lời giải:
a) Phương pháp thu lấy rượu (dung dịch ethyl alcohol) có lẫn trong cơm rượu sau khi lên men: Phương pháp chưng cất phân đoạn.
b) Phương pháp thu tinh dầu từ vỏ cam: Phương pháp chưng cất lôi cuốn hơi nước; Ngoài ra, sau khi chưng cất thu được hỗn hợp tinh dầu có lẫn nước, sử dụng tiếp phương pháp chiết để thu tinh dầu nguyên chất.
Thí nghiệm 2 trang 60 Hoá học 11
Chưng cất ethyl alcohol
Chuẩn bị: Cồn khoảng 30o; bộ dụng cụ chưng cất thường (gồm bình cầu 250 mL, sinh hàn thẳng, nhiệt kế), bình tam giác, ống đong, phễu thuỷ tinh, đũa thuỷ tinh, bếp điện, giá thí nghiệm.
Tiến hành: Cho khoảng 100 mL cồn khoảng 30° vào bình cầu 250 mL, thêm đá bọt vào bình cầu. Chưng cất và thu lấy phân đoạn chất lỏng có nhiệt độ sôi 75°C – 80°C. Dùng ống đong đo thể tích chất lỏng chưng cất được.
Yêu cầu: Ghi lại nhiệt độ chưng cất và thể tích của chất lỏng thu được.
Lời giải:
Học sinh làm thí nghiệm và ghi lại nhiệt độ chưng cất, thể tích của chất lỏng thu được.
IV. Phương pháp sắc kí
Câu hỏi 3 trang 61 Hoá học 11
Quan sát Hình 9.4 và cho biết trong điều kiện thí nghiệm:
a) Chất màu đỏ hay chất màu xanh bị hấp phụ mạnh hơn?
b) Chất màu đỏ hay chất màu xanh được hoà tan tốt hơn trong dung môi?
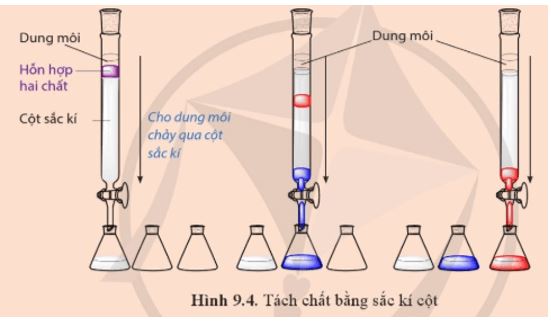
Lời giải:
Chất được hấp phụ kém trên bề mặt pha tĩnh và tan tốt trong dung môi sẽ đi ra khỏi cột sắc kí trước, còn chất được hấp phụ mạnh trên bề mặt pha tĩnh và kém tan trong dung môi sẽ đi ra sau.
a) Chất màu đỏ ra khỏi cột sắc kí sau nên bị hấp phụ mạnh hơn.
b) Chất màu xanh ra khỏi cột sắc kí trước nên tan tốt trong dung môi hơn.
Bài tập (trang 62)
1. Bài 1 trang 62 Hoá học 11
Ethyl iodide có khối lượng riêng là 1,94 g mL-1 và có nhiệt độ sôi là 72 oC. Ethanol có khối lượng riêng là 0,789 g mL-1 và có nhiệt độ sôi là 78 oC. Ethanol tan trong nước còn ethyl iodide kém tan trong nước nhưng tan được trong ethanol. Ethyl iodide thường được điều chế từ ethanol và sản phẩm thu được thường bị lẫn ethanol. Đề xuất phương pháp tinh chế ethyl iodide từ hỗn hợp của chất này với ethanol.
Lời giải:
- Do ethyl iodide và ethanol có nhiệt độ sôi xấp xỉ nhau nên không dùng phương pháp chưng cất.
- Ethanol tan trong nước còn ethyl iodide kém tan trong nước nhưng tan được trong ethanol và khối lượng riêng của ethyl iodide lớn hơn nhiều so với khối lượng riêng ethanol nên có thể dùng phương pháp chiết lỏng – lỏng trong dung môi nước.
- Ngoài ra có thể sử dụng phương pháp sắc kí để tinh chế ethyl iodide từ hỗn hợp của chất này với ethanol.
2. Bài 2 trang 62 Hoá học 11
Hình 9.5 mô tả dụng cụ dùng để tách các chất lỏng ra khỏi nhau.
a) Phương pháp nào đã được sử dụng để tách các chất ra khỏi nhau trong trường hợp này?
b) Tên của các quá trình chuyển trạng thái của các chất từ vị trí A sang vị trí B, từ vị trí B sang vị trí C là gì?
c) Thành phần các chất ở các vị trí A và C có giống nhau không? Vì sao?
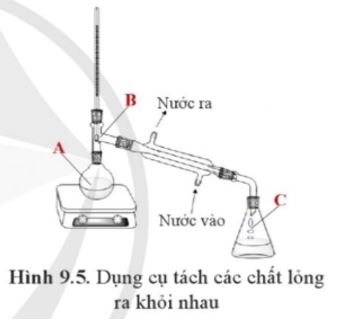
Lời giải:
a) Phương pháp chưng cất đã được sử dụng để tách chất trong trường hợp này.
b) Quá trình chuyển trạng thái của chất từ vị trí A sang vị trí B là quá trình bay hơi;
Quá trình chuyển trạng thái của chất từ vị trí B sang vị trí C là quá trình ngưng tụ.
c) Thành phần các chất ở vị trí A và C không giống nhau, do sau quá trình chưng cất ta thu được chất tinh khiết hơn (ở vị trí C).
3. Bài 3 trang 62 Hoá học 11
Hình 9.6 mô phỏng thiết bị dùng để chưng cất tinh dầu bằng phương pháp chưng cất lôi cuốn hơi nước. Biết rằng tinh dầu có khối lượng riêng nhỏ hơn 1 g mL-1.
a) Tinh dầu nằm ở phần nào (A hay B)?
b) Phương pháp để tách A và B ra khỏi nhau là phương pháp gì?
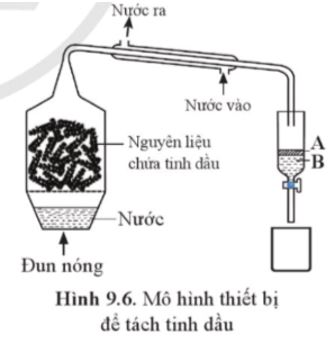
Lời giải:
a) Tinh dầu nằm ở phần (A) do tinh dầu nhẹ hơn nước nên nổi lên trên nước.
b) Phương pháp để tách A và B ra khỏi nhau là phương pháp chiết.
-------------------
Trên đây VnDoc.com vừa gửi tới bạn đọc bài viết Hóa học 11 Cánh Diều bài 9. Hi vọng qua bài viết này bạn đọc có thêm tài liệu để học tập tốt hơn môn Hóa học 11 Cánh diều.









