Lý thuyết Khoa học tự nhiên 7 bài 2 KNTT
Chúng tôi xin giới thiệu bài Lý thuyết KHTN lớp 7 bài 2: Nguyên tử được VnDoc sưu tầm và tổng hợp các câu hỏi lí thuyết và trắc nghiệm có đáp án đi kèm nằm trong chương trình giảng dạy môn Khoa học tự nhiên 7 sách Kết nối tri thức. Mời quý thầy cô cùng các bạn tham khảo tài liệu dưới đây.
Bài: Nguyên tử
A. Lý thuyết KHTN 7 bài 2
1.1. Quan niệm ban đầu về nguyên tử
- Hàng ngàn năm trước, nhiều nhà thông thái Hy Lạp mà đại diện là Đề-mô-crit (Democritus), đã cho rằng: sự tồn tại của một loại hạt vô cùng nhỏ (được gọi là nguyên tử) tạo nên sự đa dạng của vạn vật. Khởi nguồn của quan niệm nguyên tử là sự chia nhỏ một vật sẽ đến một giới hạn "không thể phân chia được".
- Khái niệm này bị lãng quên cho đến đầu thế kỉ XIX mới được nhắc lại qua giải thích của Đan-tơn (J. Dalton) (1766 - 1844), nhà khoa học người Anh. Khi tiến hành các thí nghiệm hóa học, ông nhận thấy tiến hành các thí nghiệm hóa học, ông nhận thấy rằng các chất tác dụng vừa đủ với nhau theo các lượng xác định.
- Điều đó chứng tỏ rằng có các đơn vị chất tối thiểu (được gọi là nguyên tử) để chúng kết hợp vừa đủ với nhau.
1.2. Mô hình nguyên tử của Rơ-dơ-pho - Bo
- Rơ-do-pho (E. Rutherford) (1871-1937), nhà vật lí người Niu-di-lân (New Zealand), đã đề xuất mô hình nguyên tử.
- Theo mô hình này, nguyên tử có cấu tạo rỗng.
- Nguyên tử có hạt nhân ở tâm mang điện tích dương và các electron mang điện tích âm, chuyển động xung quanh hạt nhân như các hành tinh quay xung quanh Mặt Trời (mẫu hành tinh nguyên tử) (xem Hình 2.1).
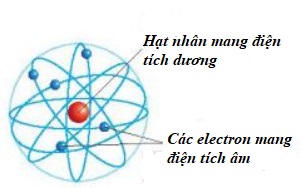
Hình 2.1. Mô hình hành tinh nguyên tử Rơ-dơ-pho
- Bo (N. Bohr) (1885 - 1962), nhà vật lí người Đan Mạch, đã hoàn thiện mô hình nguyên tử của Rơ-do-pho. Theo Bo, các electron chuyển động xung quanh hạt nhân theo từng lớp khác nhau. Lớp electron trong cùng chứa tối đa 2 electron và bị hạt nhân hút mạnh nhất. Các lớp electron khác chứa tối đa 8 electron hoặc nhiều hơn và bị hạt nhân hút yếu hơn (xem Hình 2.2).
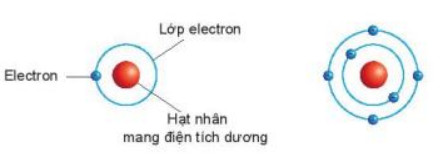
a) Nguyên tử hydrogen b) Nguyên tử carbon
Hình 2.2. Mô hình nguyên tử của hydrogen và carbon theo Bo
1.3. Cấu tạo nguyên tử
a. Hạt nhân nguyên tử
- Nguyên tử có kích thước vô cùng nhỏ, chỉ khoảng một phần mười tỉ mét. Kích thước của hạt nhân còn nhỏ hơn nữa và chỉ bằng khoảng một phần mười ngàn kích thước của nguyên tử.
- Hạt nhân nguyên tử tạo thành từ các hạt proton và neutron. Hạt proton kí hiệu là P, hạt neutron kí hiệu là n. Hạt neutron không mang điện. Mỗi hạt proton mang một đơn vị điện tích dương, quy ước là +1. Số đơn vị điện tích hạt nhân, kí hiệu là Z, bằng tổng số hạt proton có trong hạt nhân.
Ví dụ: Hạt nhân nguyên tử helium có 2p, 2n được mô tả trong Hình 2.4.
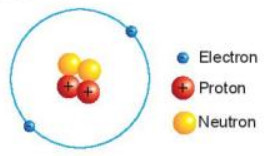
Hình 2.4. Mô hình nguyên tử Helium
b. Vỏ nguyên tử
- Vỏ nguyên tử được tạo nên bởi các electron. Mỗi electron mang một đơn vị điện tích âm, quy ước là -1. Các electron sắp xếp thành từng lớp. Lớp electron thứ nhất ở trong cùng, gần hạt nhân nhất có tối đa là 2 electron; lớp thứ hai có tối đa là 8 electron,... Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết. Các electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tử.
Ví dụ: Vỏ nguyên tử carbon có 6 electron sắp xếp vào hai lớp, lớp trong cùng có 2 electron, lớp tiếp theo có 4 electron (xem Hình 2.2b).
- Như vậy, nguyên tử là hạt vô cùng nhỏ tạo nên các chất. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm. Nguyên tử trung hòa về điện nên tổng số hạt proton bằng tổng số hạt electron.
|
- Nguyên tử là hạt vô cùng nhỏ, trung hòa về điện, Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm. - Hạt nhân nguyên tử gồm các hạt proton mang điện tích dương và neutron không mang điện. - Vỏ nguyên tử gồm các hạt electron mang điện tích âm sắp xếp thành từng lớp. |
|---|
1.4. Khối lượng nguyên tử
- Khối lượng nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân và các hạt electron ở vỏ nguyên tử.
- Khối lượng nguyên tử vô cùng nhỏ, để thuận tiện cho việc sử dụng, người ta dùng đơn vị khối lượng nguyên tử, viết tắt là amu. Một proton có khối lượng gần đúng bằng khối lượng của một neutron và xấp xỉ bằng 1 amu. Một electron có khối lượng xấp xỉ bằng 0,00055 amu.
| Khối lượng nguyên tử tập trung ở hạt nhân, được coi bằng khối lượng của hạt nhân và có đơn vị là amu. |
|---|
B. Bài tập minh họa KHTN 7 bài 2
Bài 1: Mọi vật thể tự nhiên hay nhân tạo đều được tạo thành từ một số loại hạt vô cùng nhỏ bé gọi là nguyên tử. Vậy nguyên tử có cấu tạo như thế nào?
Hướng dẫn giải
- Nguyên tử có kích thước vô cùng nhỏ, cấu tạo rỗng.
- Gồm 3 hạt:
+ Proton mang điện tích dương
+ Neutron không mang điện
+ Electron mang điện tích âm
Bài 2: Hãy cho biết nguyên tử là gì
Hướng dẫn giải
- Nguyên tử là những hạt cực kì nhỏ bé, không mang điện
Ví dụ: Đồng tiền vàng được cấu tạo từ nguyên tử vàng
Kim cương, than chì đều được cấu tạo từ nguyên tử carbon
Nước được tạo nên từ các nguyên tử hydrogen và oxygen
Bài 3: Nhôm (aluminium) là kim loại có nhiều ứng dụng trong thực tiễn, được dùng làm dây dẫn điện, chế tạo các thiết bị, máy móc trong công nghiệp và nhiều đồ dùng sinh hoạt. Cho biết tổng số hạt trong hạt nhân nguyên tử nhôm là 27, số đơn vị điện tích hạt nhân là 13. Tính số hạt mỗi loại trong nguyên tử nhôm và cho biết điện tích hạt nhân của nhôm?
Hướng dẫn giải
- Vì hạt nhân gồm có proton và neutron
→ Tổng số hạt trong hạt nhân = số proton + số neutron
→ 27 = số proton + số neutron
- Mà số đơn vị điện tích hạt nhân = số proton = 13 = số electron
→ Số neutron = 27 – 13 = 14
Vậy trong nguyên tử nhôm có: 13 hạt electron, 13 hạt proton, 14 hạt neutron
------------------------------------
Chúng tôi xin giới thiệu nội dung bài Lý thuyết Khoa học tự nhiên 7 bài 2: Nguyên tử KNTT trên đây các bạn có thể tham khảo Toán lớp 7 tập 1 Kết nối tri thức và Ngữ Văn 7 Tập 1 Kết nối tri thức, Công Nghệ 7 KNTT,...... theo chuẩn kiến thức, kỹ năng của Bộ GD&ĐT ban hành. VnDoc.com liên tục cập nhật Lời giải, đáp án các dạng bài tập Chương trình sách mới cho các bạn cùng tham khảo.









