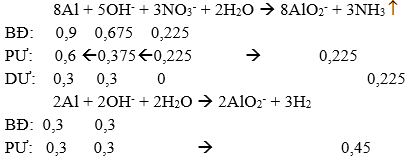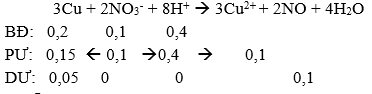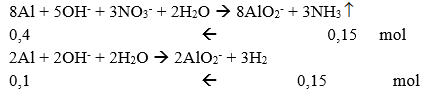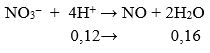1
Hòa tan hết 15,0 gam hỗn hợp X gồm Fe, Fe3O4, FeCO3 và Fe(NO3)2 trong dung dịch chứa NaHSO4 và 0,16 mol HNO3 thu được dung dịch Y và hỗn hợp khí Z gồm CO2 và NO (tỉ lệ mol tương ứng 1 : 4). Dung dịch Y hòa tan tối đa 8,64 gam bột Cu, thấy thoát ra 0,03 mol khí NO. Nếu cho dung dịch Ba(OH)2 dư vào Y, thu được 154,4 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn và khí NO là sản phẩm khử duy nhất của cả quá trình. Phần trăm khối lượng của Fe đơn chất trong hỗn hợp X là:
Cu + Y → sinh ra NO ⇒ chứa H+ và NO3- không chứa Fe2+
Ta có sơ đồ phản ứng:
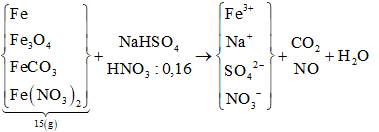
nH+ du = 4nNO = 0,12 mol
Bảo toàn e: 2nCu = nFe3+ + 3nNO ⇒ nFe3+ = 0,18 mol
Xét Ba(OH)2 + Y ⇒ ↓ gồm Fe(OH)3 và BaSO4 → nBaSO4 = 0,58 mol
Bảo toàn gốc SO4: nNaHSO4 = nSO42-/Y = nBaSO4 = 0,58 mol ⇒ nNa+/Y
Bảo toàn điện tích: nNO3- = 0,18 mol
Bảo toàn nguyên tố Hidro: nH2O = 0,31 mol
Bảo toàn khối lượng: mZ = 4,92 (g) → dễ giải ra được 0,03 mol CO2; 0,12 mol NO
Bảo toàn nguyên tố Nito: nFe(NO3)2 = 0,02 mol; nFeCO3 = nCO2 = 0,03 mol
nH+ pư = 2nO + 4nNO + 2nCO3 ⇒ nO = 0,04 mol ⇒ nFe3O4 = 0,01 mol
Bảo toàn nguyên tố Fe: nFe = 0,1 mol ⇒ %mFe = (0,1.56) : (15.100%) = 37,33%
→ Đáp án C