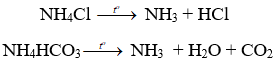Chất làm khô khí NH3?
VnDoc xin giới thiệu bài Chất làm khô khí NH3? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 11. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Chất nào làm khô khí NH3?
Câu hỏi: Chất nào làm khô khí NH3?
Trả lời:
Chất có thể làm khô NH3 là NaOH rắn.
I. Công thức hóa học của amoniac
- Amoniac bắt nguồn từ tiếng Pháp ammoniac và được phiên dịch ra tiếng việt là a-mô-ni-ắc.
- Đây là một hợp chất vô cơ có công thức phân tử là NH3.
- Amoniac là một hợp chất vô cơ được cấu tạo từ 3 nguyên tử nitơ và 1 nguyên tử hidro tạo thành liên kết kém bền
II. Tính chất vật lý của Amoniac
- Amoniac thường tồn tại ở dạng khí, không màu, có mùi hôi khó chịu. Nồng độ Amoniac lớn có thể gây chết người.
- Amoniac có độ phân cực lớn do phân tử NH3 có cặp electron tự do và liên kết N–H bị phân cực. Do đó NH3 là chất dễ hóa lỏng.
- Dung dịch Amoniac là dung môi hoà tan tốt: NH3 hoà tan các dung môi hữu cơ dễ hơn nước do có hằng số điện môi nhỏ hơn nước. Kim loại kiềm và các kim loại Ca, Sr, Ba có thể hòa tan trong NH3 lỏng tạo dung dịch xanh thẫm.
III. Tính chất hóa học
1. Tính bazơ yếu
- Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
2. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
3. Tính khử
- Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
- Tác dụng với oxi:

- Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
- Tác dụng với CuO:
IV. Amoniac có nguồn gốc từ đâu?
Amoniac cũng được sinh ra trong trong tự nhiên thông qua:
- Con người: Cơ quan thận cũng sản sinh ra một lượng nhỏ khí nh3, chính vì vậy mà nước tiểu thường có mùi khai đặc trưng của khí amoniac.
- Sinh vật: Được hình thành từ xác động vật hay thực vật sau một thời gian phân hủy dưới tác động của các vi sinh vật tạo thành khí nh3.
V. Điều chế
Trong công nghiệp:
- Nguyên liệu: N2 và H2
- PTHH:
![]()
Trong phòng thí nghiệm: có 2 cách:
(1) Cho muối amoni tác dụng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 + H2O
(2) Nhiệt phân muối amoni:
VI. Ứng dụng của NH3
Amoniac được dùng rộng rãi trong đời sống cũng như ứng dụng trong công nghiệp. Dưới đây sẽ là một vài ví dụ điển hình về ứng dụng của Amoniac
Phân bón
Trên thực tế có đến khoảng 83% amoniac lỏng được dùng làm phân bón vì trong tất cả các hợp chất Nito đều có nguồn gốc từ NH3, rất cần thiết cho sự phát triển của cây trồng.
Dùng làm thuốc tẩy
Amoniac được dùng trong hộ gia đình là dung dịch NH3 trong nước được sử dụng làm chất tẩy rửa cho nhiều bề mặt. Amoniac lỏng tạo ra ánh sáng rực rỡ.
Trong ngành dệt may
Amoniac lỏng được sử dụng để điều trị nguyên liệu bông, cung cấp cho một tài sản kiềm bóng sử dụng chất kiềm. Đặc biệt, nó được sử dụng để rửa tiền len.
Xử lý môi trường khí thải
Amoniac lỏng được sử dụng trong xử lý môi trường nhằm loại bỏ các chất như Nox, Sox trong các khí thải khí đốt các nguyên liệu hóa thạch như than, đá…
Là chất chống khuẩn trong thực phẩm
Amoniac là một chất khử mạnh, Amoniac khan hiện được sử dụng với mục đích thương mại để giảm hoặc loại bỏ nhiễm khuẩn của thịt bò.
Trong công nghiệp chế biến gỗ
Amoniac lỏng được sử dụng trong chế biến gỗ, làm cho màu sắc đậm hơn bởi khí Amoniac phản ứng với tự nhiên trong gỗ và làm thay đổi màu sắc đẹp hơn.
Sử dụng trong ngành công nghiệp dầu khí
Sử dụng Amoniac trong trung hòa acid, thành phần của dầu thô và bảo vệ các thiết bị khỏi bị ăn mòn.
Trong ngành công nghiệp khai thác mỏ
Amoniac được sử dụng để khai thác các kim loại như đồng niken và molypden từ quặng của họ.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Chất làm khô khí NH3? Mời các bạn tham khảo thêm tài liệu: Giải bài tập Hóa học lớp 11, Giải SBT Hóa Học 11, Trắc nghiệm Hóa học 11, Tài liệu học tập lớp 11