Đề cương ôn tập học kì 2 Hóa 12 năm 2025 Có đáp án (Cấu trúc mới)
Đề cương ôn tập học kì 2 Hóa 12 Chương trình mới
Đề cương ôn tập học kì 2 Hóa 12 năm 2025 Có đáp án được VnDoc biên soạn tổng hợp bộ câu hỏi bám sát chương trình mới Hóa học 12. Nội dung câu hỏi chia làm 3 phần:
- Phần I. Câu trắc nghiệm nhiều phương án lựa chọn
- Phần II. Câu trắc nghiệm đúng sai
- Phần III. Câu trắc nghiệm trả lời ngắn
NỘI DUNG 1. ĐẠI CƯƠNG KIM LOẠI
Phần I. Câu hỏi trắc nghiệm nhiều phương án lựa chọn
Câu 1. Tính chất hóa học chung của kim loại là
A. tính khử.
B. tính oxi hóa.
C. tính acid.
D. tính base.
Câu 2. Kim loại cứng nhất và kim loại dẫn điện tốt nhất lần lượt là
A. Cr và Ag .
B. Ni và Cu.
C. Cr và Cu.
D. Ni và Al.
Câu 3. Kim loại có nhiệt độ nóng chảy cao nhất và thấp nhất lần lượt là
A. W và Na.
B. W và Hg.
C. Cr và Na.
D. Cr và W.
Câu 4. Nguyên tử nào dưới đây không phải kim loại?
A.15P.
B. 11Na.
C. 13Al.
D. 28Ni.
Câu 5. Cho các kim loại: 11 Na, 12 Mg, 20 Ca, 26 Fe. Có bao nhiêu kim loại nguyên tử có 2 electron lớp ngoài cùng ?
A. 1.
B. 4.
C. 2.
D. 3.
Câu 6. Dãy kim loại nào sau đây sắp xếp theo thứ tự độ dẫn điện giảm dần?
A. Au, Ag, Cu, Al.
B. Ag, Au, Al, Cu.
C. Cu, Al, Ag, Au.
D. Ag, Cu, Au, Al.
Câu 7 . Dãy xếp theo chiều tăng dần tính oxi hóa là:
A. Na+, Fe2+, Al3+.
B. Mg2+, Fe2+, Cu2+.
C. Al3+, Na+, Mg2+.
D. H+, Cu2+, Fe2+.
Câu 8. Cho các kim loại: Na, Mg, Al, Fe, Cu, Ag. Số kim loại tan trong dung dịch HCl (không có không khí) là
A. 4.
B. 5.
C. 3.
D. 2.
Câu 9. Để khử ion Fe2+ trong dung dịch FeSO 4 có thể dùng
A. Na.
B. Al.
C. K.
D. Cu.
Câu 10. Cho các kim loại: Na, Zn, Fe, Al, Ag. Số kim loại khử được ion Cu2+ trong dung dịch CuSO4 là
A. 3.
B. 2.
C. 4.
D. 5.
Còn tiếp ....
Phần II. Câu hỏi trắc nghiệm đúng sai
Câu 1. Thả một đinh sắt nặng m1 gam đã được đánh sạch bề mặt vào cốc chứa dung dịch copper(II) sulfate màu xanh. Sau một thời gian thấy toàn bộ lượng đồng sinh ra đã bám vào "đinh sắt" (thực chất là phần đinh sắt chưa phản ứng). Lấy "đinh sắt" ra khỏi cốc dung dịch, sấy khô, đem cân được m2 gam.
a) Phản ứng diễn ra là:
b) Màu xanh của dung dịch copper(II) sulfate nhạt dần.
c) So sánh, thu được kết quả m2< m1.
d) Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch không thay đổi.
Trả lời
(a) Sai, vì phản ứng tạo thành họp chất iron(II):
Fe(s) + Cu2+(aq) → Fe2+(aq) + Cu(s).
b) Đúng, màu xanh của dung dịch nhạt dần do nồng độ Cu2+giảm dần trong phản ứng.
c) Sai, tỉ lệ mol của Fe và Cu theo phản ứng là 1 : 1. Nếu 1 mol Fe tham gia phản ứng và tan (56 g) sẽ có 1 mol Cu sinh ra và bám vào “đinh sắt”. Vì lượng kim loại tan ra nhỏ hơn lượng bám vào (56 g < 64 g) nên làm cho khối lượng của “đinh sắt” lớn hơn khối lượng của đinh sắt ban đầu.
d) Sai, vì xảy ra phản ứng Zn(s) + Cu2+(aq) →→Zn2+(aq) + Cu(s). Khi đó, nồng độ Cu2+giảm do bị khử bởi Zn và màu xanh của dung dịch nhạt dần.
Câu 2. Cho 4,958 lít khí CO (ở đkc) từ từ đi qua ống sứ nung nóng đựng 8 g một oxide sắt đến khi phản ứng xảy ra hoàn toàn. Khi thu được sau phản ứng có tỉ khối so với H2 bằng 20.
a) Công thức của oxide sắt là Fe2O3.
b) Phần trăm thể tích CO2trong hỗn hợp khí sau phản ứng là 75%.
c) Hỗn hợp khí sau phản ứng có thể tích 4,958 lít (ở đkc).
d) Khối lượng chất rắn thu được là 5,6 g.
Trả lời
4 đáp án đều đúng
Câu 3. Sự ăn mòn điện hoá xảy ra khi
a) cho miếng hợp kim Ag - Cu trong dung dịch HCl loãng.
b) đặt hợp kim Zn - Cu trong không khí ẩm.
c) đốt hợp kim Zn - Fe trong bình chứa khí O2dư.
d) ngâm kim loại Cu tinh khiết trong dung dịch muối ăn.
Trả lời
a) sai. Không xảy ra ăn mòn điện hóa.
b) đúng.
c) sai. Xảy ra ăn mòn hoá học.
d) sai. Không xảy ra ăn mòn điện hóa do không xuất hiện 2 điện cực.
Còn tiếp ....
Phần 3. Câu trắc nghiệm yêu cầu trả lời ngắn
Câu 1. Để bảo vệ sắt khỏi bị ăn mòn, trong thực tế người ta thường mạ lên bề mặt các đồ vật bằng sắt một lớp kim loại bảo vệ. Tôn và sắt tây là hai loại vật liệu rất phổ biến. Tôn là sắt được mạ một lớp kẽm, sắt tây là sắt được mạ một lớp thiếc. Khi sử dụng một thời gian (trong môi trường không khí ẩm), nếu lớp mạ bị bong sẽ để lộ ra phần sắt bên trong. Có các phát biểu sau:
- Phương pháp bảo vệ dùng ở tôn và sắt tây là bảo vệ điện hóa.
- Với tôn, khi lớp mạ bị bong, sắt sẽ bị ăn mòn điện hóa.
- Với sắt tây, khi lớp mạ bị bong, phần kim loại bên trong sẽ bị ăn mòn rất
- Để bảo vệ các đồ vật làm bằng sắt thép, có thể gắn những tấm đồng lên trên bề mặt.
- Khi đóng đinh để cố định các tấm tôn lại với nhau, sau một thời gian, tại vị trí đóng đinh sẽ bị ăn mòn.
Có bao nhiêu phát biểu đúng?
Câu 2. Cho các phát biểu sau:
- Các kim loại kiềm đều tan trong nước ở nhiệt độ thường.
- Các kim loại Ca, Fe, Al và Na chỉ điều chế bằng phương pháp điện phân nóng chảy.
- Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành
- Cho Mg vào dung dịch FeCl3 dư, không thu được
Số phát biểu nào đúng?
Trả lời: 1
Câu 3. Hòa tan hỗn hợp bột kim loại gồm 8,4 g Fe và 6,4 g Cu vào 350 mL dung dịch AgNO3 2 M. Sau khi phản ứng xảy ra hoàn toàn thu được bao nhiêu gam chất rắn?
Trả lời: 70,2 gam
Fe = 0,15 mol; nCu = 0,1 mol
nAgNO3= 0,7 mol > 3.nFe+ 2nCu ⇒ AgNO3 dư
Fe + 3AgNO3 → Fe(NO3)3 + 3Ag
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
mchất rắn = mAg = (0,15.3 + 0,1.2).108 = 70,2 g
Còn tiếp...
NỘI DUNG 2. NGUYÊN TỐ NHÓM IA và IIA
Phần 1. Câu hỏi trắc nghiệm nhiều phương án lựa chọn
Câu 1. Nguyên tố nào là kim loại kiềm ?
A. Na.
B. Ca.
C. Mg.
D. Al.
Câu 2. Kim loại nào dưới đây có 2 electron lớp ngoài cùng?
A. Li.
B. Na.
C. K.
D. Mg.
Câu 3 . Nguyên tử nguyên tố X có cấu hình electron lớp ngoài cùng là 4s1. X là
A. Na.
B. K.
C. Mg.
D. Ca.
Câu 4. Kim loại X tan trong nước thu được dung dịch trong suốt. X là
A. Li.
B. Fe.
C. Mg.
D. Al.
Câu 5 . Kim loại kiềm X ở chu kì 3. Số hiệu nguyên tử của X là
A. 11.
B. 12.
C. 19.
D. 20.
Câu 6. Dãy xếp theo chiều tăng dần tính khử là:
A. Li, Na, K, Rb.
B. Li, Na, Rb, K.
C. Rb, K, Na, Li.
D. Rb, Na, K, Li.
Câu 7. Phát biểu nào sai?
A. Các kim loại kiềm đều có độ cứng lớn.
B. Kim loại kiềm có số oxi hóa +1 trong các hợp chất.
C. Kim loại kiềm có cùng kiểu mạng tinh thể.
D. Các kim loại kiềm đều có 1 electron lớp ngoài cùng.
Câu 8. Phát biểu nào đúng ?
A. Phương pháp điều chế kim loại kiềm là điện phân dung dịch muối halide.
B. Kim loại kiềm R tác dụng với khí Cl2, thu được muối RCl2.
C. Trong nhóm IA, từ Li đến Cs, tính kim loại mạnh dần.
D. Các kim loại kiềm đều có nhiệt độ nóng chảy cao
Câu 9. Cho kim loại R vào dung dịch FeCl 3 , sau phản ứng thu được kết tủa màu nâu đỏ. R là
A. Mg.
B. Fe.
C. Cu.
D. Na.
Câu 10. Qúa trình nào dưới đây xảy ra sự khử ion Na+ ?
A. Điện phân dung dịch NaCl.
B. Cho dung dịch HCl vào dung dịch NaHCO3.
C. Điện phân nóng chảy NaCl.
D. Nhỏ dung dịch NaOH vào dung dịch CuSO4.
Câu 11. Cho dung dịch NaOH đến dư lần lượt vào từng dung dịch: Al2(SO4)3, MgCl2, FeCl3, AgNO3, CuSO4. Số trường hợp thu được chất kết tủa là
A. 3.
B. 5.
C. 2.
D. 4.
Câu 12. Quặng dolomite là một khoáng sản hiếm tập trung chủ yếu ở các tỉnh như Hà Nam, Ninh Bình, Nghệ An, Thanh Hoá,… Công thức hoá học của quặng dolomite là
A. MgCO3.BaCO3.
B. CaSO4.2H2O.
C. Al2O3.nH2O.
D. MgCO3.CaCO3.
Câu 13. Nước cứng là nước chứa nhiều các ion
A. HCO3-, Cl- .
B. Ca2+, Ba2+.
C. Ca2+, Mg2+.
D. Cl- , SO42-.
Phần 2. Câu hỏi trắc nghiệm đúng sai
Câu 1. Trong công nghiệp, người ta điều chế NaOH bằng phương pháp điện phân dung dịch NaCl bão hòa với các điện cực trơ, có màng ngăn. Sơ đồ điện phân như hình vẽ bên.
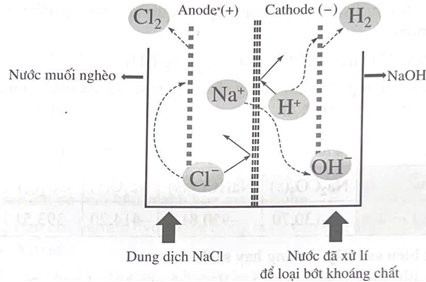
- Ở cathode xảy ra quá trình khử H2O, ở anode xảy ra quá trình oxi hóa Cl-.
- Màng ngăn cho ion Na+ đi qua nhưng không cho Cl- và OH- đi qua.
- Số mol khí thu được ở hai điện cực bằng
- Dung dịch NaCl đi vào có nồng độ 300 g/L, nước muối nghèo đi ra có nồng độ 220 g/L. Vậy với mỗi lít nước muối bão hòa ban đầu sẽ thu được tối đa khoảng 54,7 gam NaOH (hiệu suất 100%).
Câu 2. Xét các phản ứng phân hủy sau:
- Lượng nhiệt tỏa ra khi phân hủy 1 mol BaCO3 nhiều hơn khi phân hủy 1 mol CaCO3.
- BaCO3 khó phân hủy hơn CaCO3.
- Khi tăng nhiệt độ, cả hai cân bằng đều dịch chuyển theo chiều thuận.
- Trong quá trình nung, CO2 cần được lấy ra khỏi lò để tăng hiệu suất phản ứng.
Câu 3. Khi nồng độ acid trong dịch vị dạ dày tăng có thể gây ra viêm loét dạ dày, tá tràng. Để giảm bớt nồng độ axit trong dịch vị dạ dày người ta thường dùng “thuốc đau dạ dày”. Thành phần chính của “thuốc đau dạ dày” là muối X.
- Muối X là sodium bicarbonate có công thức hóa học là Na2CO3
- Muối X còn được dùng để tạo độ xốp cho bánh, làm mềm thực phẩm.
- Muối X bị phân hủy khi đun nóng.
- Trong công nghiệp, muối X được sản xuất bằng phương pháp Solvay.
Phần 3. Câu hỏi trắc nghiệm trả lời ngắn
Câu 1. Cho dãy các kim loại: Fe, Na, K, Cu, Mg, Ba, Be, Ca, Sn. Số kim loại trong dãy phản ứng mạnh với nước ở nhiệt độ thường?
Hướng dẫn trả lời
Các kim loại tác dụng với nước ở nhiệt độ thường là: Na, K, Ba, Ca, Sn
Vậy có 5
Trong mẫu nước có chứa các chất sau: MgCO3, BaCl2, CaSO4, Mg(HCO3)2, MgCl2, BaSO4, Ca(HCO3)2, CaCl2, Ba(HCO3)2, MgSO4. Có bao nhiêu chất trong mẫu nước được gọi là nước cứng?
Hướng dẫn trả lời
Các chất có trong mẫu nước được gọi là nước cứng là: MgCl2, MgSO4, CaCl2, CaSO4, Mg(HCO3)2, Ca(HCO3)2
Vậy có 6 chất
NỘI DUNG 3. SƠ LƯỢC VỀ DÃY KIM LOẠI CHUYỂN TIẾP THỨ NHẤT VÀ PHỨC CHẤT
SƠ LƯỢC VỀ DÃY KIM LOẠI CHUYỂN TIẾP THỨ NHẤT
Phần 1. Câu hỏi trắc nghiệm nhiều phương án lựa chọn
1. Mức độ nhận biết
Câu 1. Kim loại nào sau đây thuộc dãy kim loại chuyển tiếp thứ nhất?
A. Ti.
B. Rb.
C. Ca.
D. K.
Câu 2. Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp là.
A. [Ne]3d1104s12.
B. [Ar]3d1104s2.
C. [Ar]3d110 4s12.
D. [Ar]3d110 4s1.
Câu 3. Sự hình thành các nguyên tố chuyển tiếp dãy thứ nhất là do có sự sắp xếp lần lượt các electron vào phân lớp?
A. 3d.
B. 4s.
C. 4p.
D. 3p.
Câu 4. Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở
A. phân lớp 3d và phân lớp 4s.
B. phân lớp 3d.
C. lớp 4s.
D. phân lớp 3p và phân lớp 3d.
Câu 5. Nguyên tử manganese có số oxi hóa +4 trong hợp chất nào sau đây?
A. KMnO4.
B. K2MnO4.
C. MnO2.
D. MnSO4.
Câu 6. Ở trạng thái cơ bản, cấu hình electron của Mn (Z = 25) là [Ar]3d54s2. Số oxi hoá cao nhất của Mn trong các hợp chất là
A. +5.
B. +7.
C. +2.
D. +6.
Chi tiết nội dung đề cương gồm 23 trang nằm trong FILE TẢI VỀ









