Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Marie Curie, TP. Hồ Chí Minh năm học 2015 - 2016
Đề thi học kì 1 môn Hóa học lớp 10
Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Marie Curie, TP. Hồ Chí Minh năm học 2015 - 2016 là đề kiểm tra học kì I lớp 10 môn Hóa có đáp án đi kèm, giúp các bạn học sinh ôn tập và nâng cao kiến thức Hóa học, chuẩn bị cho kỳ thi học kì 1 đạt điểm số cao. Mời các bạn tham khảo.
Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Yên Lạc 2, Vĩnh Phúc năm học 2014 - 2015
|
Trường THPT Marie Curie ĐỀ KIỂM TRA CHÍNH THỨC
|
ĐỀ KIỂM TRA HỌC KỲ I NĂM HỌC 2015-2016 MÔN HÓA HỌC – KHỐI 10 Thời gian làm bài: 45 phút |
A. Phần Lý thuyết (7 điểm)
Câu 1 (2 điểm)
Cho các nguyên tử: K (Z = 19) và F (Z = 9)
a) Viết cấu hình electron của hai nguyên tử trên;
b) Xác định vị trí của hai nguyên tố trên trong bảng tuần hoàn, giải thích.
Câu 2 (2 điểm)
Cho các nguyên tố: N, O, Cl, P, S
Xếp các nguyên tố trên theo tính phi kim tăng dần, giải thích.
Câu 3 (1 điểm)
Viết phương trình có biểu diễn chiều dịch chuyển electron trong sự hình thành liên kết ion trong phân tử KF. Cho: K (Z = 19) và F (Z = 9)
Câu 4 (1 điểm)
Theo quy tắc bát tử, hãy viết công thức cấu tạo của các hợp chất sau: SiO2, SO2, H2O2, HNO3
Câu 5 (1 điểm)
a) Cân bằng phản ứng oxi hóa-khử theo phương pháp thăng bằng electron
b) Xác định chất khử, chất oxi hóa, qúa trình oxi hóa, quá trình khử
K2Cr2O7 + HBr + H2SO4 → Br2 + Cr2(SO4)3 + K2SO4 + H2O
B. Phần Toán (3 điểm)
Công thức oxit cao nhất của một nguyên tố R có dạng R2O7. Trong hợp chất của R với hidro có 97,26% R về khối lượng.
a) Xác định tên nguyên tố R.
b) Hòa tan hợp chất của R với H vào nước thu được dung dịch X. Cho 2,4 gam một kim loại M thuộc nhóm IIA tác dụng hoàn toàn với dung dịch X, thấy thoát ra 2,24 lit khí hidro (điều kiện tiêu chuẩn). Xác định tên của kim loại M và khối lượng chất tan có trong dung dịch X.
Cho biết các phản ứng đều xảy ra hoàn toàn.
HỌC SINH KHÔNG ĐƯỢC SỬ DỤNG BẢNG TUẦN HOÀN VÀ BẢNG TÍNH TAN CÁC CHẤT
Cho: Zn = 65; Fe = 56; Cl = 35,5; Mg = 24; Ba = 137
Đáp án đề thi học kì 1 môn Hóa học lớp 10
A. Phần Lý thuyết (7 điểm)
Câu 1 (2 điểm)
a) Cấu hình K (Z = 19) 1s2 2s2 2p6 3s2 3p6 4s1
F (Z = 9) 1s2 2s2 2p5
b) Vị trí
K thuộc ô 19 (Z = 19)
Chu kỳ 4 (vì có 4 lớp electron)
Nhóm IA (vì có 1 electron lớp ngoài cùng)
F thuộc ô 9 (Z = 9)
Chu kỳ 2 (vì có 2 lớp electron)
Nhóm VIIA (vì có 7 electron lớp ngoài cùng)
Câu 2 (2 điểm)
* Trong chu kỳ từ trái sang phài tính phi kim tăng dần
Chu kỳ 2: N < O
Chu kỳ 3: p < S < Cl
* Trong nhóm A từ trên xuống tính phi kim giảm
Nhóm VA: p < N
Nhóm VI A: S < O
Câu 3 (1 điểm)
2K + F2 → 2KF
![]()
Câu 4 (1 điểm)
SiO2 O = Si = O
SO2 O = S → O
H2O2 H – O – O – H
HNO3 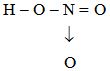
Câu 5 (1 điểm)
a) 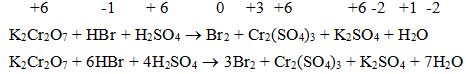
b) Chất khử: Br- trong HBr
Chất oxi hóa: Cr+6 trong K2Cr2O7
Quá trình oxi hóa: Br -1 → Br0 + 1e
Quá trình khử: Cr+6 +3e → Cr+3
B. Phần Toán (3 điểm)
a) Công thức oxit cao nhất là R2O7 => Công thức hợp chất với hidro là HR
Phần trăm về khối lượng của H: 100 - 97,26 = 2,74%
Lập tỉ lệ: ![]()
=> R = 35,49
Tên nguyên tố R là clo
b) 2HCl + M → MCl2 + H2
Số mol khí hidro: 2,24/22,4 = 0,1 mol
Số mol M: 0,1 mol
Khối lượng nguyên tử M: 2,4/0,1 = 24
Số mol muối HCl: 0,2 mol
Khối lượng HCl: 0,2 x 36,5 = 7,3 gam



