Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Yên Lạc 2, Vĩnh Phúc năm học 2014 - 2015
Đề thi học kì 1 môn Hóa học lớp 10
Đề thi học kì 1 môn Hóa học lớp 10 trường THPT Yên Lạc 2, Vĩnh Phúc năm học 2014 - 2015 gồm 6 câu hỏi tự luận, kiểm tra kiến thức Hóa học trong nửa đầu năm học của học sinh. Đề kiểm tra học kì I môn Hóa lớp 10 có đáp án đi kèm, giúp các bạn học sinh ôn tập một cách hiệu quả nhất. Mời các bạn tham khảo.
Đề thi học kì 1 môn Toán lớp 10 trường THPT Trần Phú, Đồng Nai năm học 2015 - 2016
Đề thi học kì 1 môn Vật lý lớp 10 trường THPT Yên Lạc 2, Vĩnh Phúc năm học 2014 - 2015
Đề thi học kì 1 môn Ngữ văn lớp 10 trường THPT Yên Lạc 2, Vĩnh Phúc năm học 2014 - 2015
|
SỞ GD&ĐT VĨNH PHÚC TRƯỜNG THPT YÊN LẠC 2
ĐỀ CHÍNH THỨC |
ĐỀ KHẢO SÁT CHẤT LƯỢNG LẦN II NĂM 2014-2015 Môn: Hóa - Lớp 10 (Thời gian làm bài 90 phút, không kể thời gian giao đề) Đề thi có 01 trang |
Câu 1: (1,5 điểm) Nguyên tử R có tổng số các loại hạt electron, proton, nơtron là 40. Xác định số lượng hạt các loại trong nguyên tử R? Viết kí hiệu nguyên tử của R?
Câu 2: (1 điểm) Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau:
| Đồng vị | 24Mg | 25Mg | 26Mg |
| % | 78,6 | 10,1 | 11,3 |
Tính nguyên tử khối trung bình của Mg.
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của hai đồng vị còn lại là bao nhiêu?
Câu 3: (2 điểm) A và B là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32. Hãy viết cấu hình electron của A, B và của các ion mà A và B có thể tạo thành.
Câu 4: (1,5 điểm) X, Y, Z là những nguyên tố có điện tích hạt nhân lần lượt là 9, 19, 8.
a, Cho biết tính chất hóa học đặc trưng của X, Y, Z?
b, Dự đoán liên kết hóa học có thể có giữa các cặp X và Y, Y và Z, X và Z. Viết công thức phân tử của các hợp chất tạo thành.
Câu 5: (2 điểm) M là kim loại thuộc nhóm IIA. Hòa tan hết 10,8 gam hỗn hợp gồm kim loại M và muối cacbonat của nó trong dung dịch HCl, thu được 4,48 lít hỗn hợp khí A (đktc). Tỉ khối của A so với khí hiđro là 11,5.
a, Tìm kim loại M
b, Tính % thể tích các khí trong A.
Câu 6: (2 điểm) Cân bằng phản ứng hóa học sau bằng phương pháp thăng bằng electron
a, Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
b, NH3 + O2 → NO + H2O
c, FeS2 + O2 → Fe2O3 + SO2
d, Fe3O4 + Al → Fe + Al2O3
....................HẾT....................
Cho KLNT của: Mg = 24, Ca= 40, Ba = 137, H = 1, O = 16, Cl = 35,5, Al = 27.
Đáp án đề thi học kì 1 môn Hóa học lớp 10
Câu 1: (1,5 điểm)
Ta có: P + E + N = 40 ↔ 2Z + N = 40 (1)
(vì trong nguyên tử P = E = Z)
Mặt khác: Z ≤ N ≤ 1,5Z (2)
Giải hệ trên ta được Z = 12, N = 16 => A = 28 (không thỏa mãn)
Hoặc Z = 13, N = 14 => A = 27 (Al)
Kí hiệu nguyên tố: ![]()
Câu 2: (1 điểm)
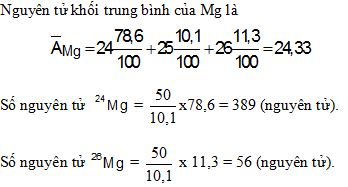
Câu 3: (2 điểm)
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A: 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 và B2+: 1s22s22p63s23p6.
Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; ZB = 25.
Cấu hình electron:
A: 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn
Câu 4: (1,5 điểm)
a. Cấu hình electron của các nguyên tử X, Y, Z:
X: (Z = 9): 1s2 2s2 2p5
Y: (Z = 19): 1s2 2s2 2p6 3s2 3p6 4s1
Z: (Z = 8): 1s2 2s2 2p4
Tính chất đặc trưng của Y là tính kim loại, của X và Z là tính phi kim.
b. Liên kết giữa X và Y, giữa Y và Z là liên kết ion.
- Sự hình thành liên kết giữa X và Y:
X + 1e → X-
Y → Y+ + 1e
X- + Y+ → YX.
- Sự hình thành liên kết giữa Y và Z:
Z + 2e→ Z2-
2Y → 2Y+ + 2 x 1e
Z2- + 2Y+ → Y2Z.
- X và Z là các phi kim nên liên kết giữa chúng là liên kết cộng hóa trị. Để đạt được cấu hình bền vững, mỗi nguyên tử X cần góp chung 1e, mỗi nguyên tử Z cần góp chung 2e. Như vậy 2 nguyên tử X sẽ tham gia liên kết với 1 nguyên tử Z bằng 2 liên kết cộng hóa trị đơn nhờ 2 cặp electron góp chung. Do đó công thức phân tử của hợp chất là X2Z
Câu 5: (2 điểm)
a. Gọi số mol các chất trong hỗn hợp đầu: M = a mol; MCO3 = b mol.
M + 2HCl → MCl2 + H2 (1)
(mol): a a
MCO3 + 2HCl → MCl2 + CO2 + H2O (2)
(mol): b b
Số mol hỗn hợp = 0,2 nên: a + b = 0,2 (3)
MA = 11,5 x 2 = 23 nên hay 2a + 44b = 4,6 (4)
Theo bài: Ma + (M + 60)b = 10,8 (5)
Từ (3), (4), (5) ta tìm được: a = 0,1 mol; b = 0,1 mol; M = 24 (Mg).
b. %VH2 = 50%; %VCO2 = 50%.
Câu 6: (2 điểm) Cân bằng đúng mỗi PTPU cho 0,5 điểm



