Đề thi thử THPT Quốc gia năm 2017 môn Hóa học trường THPT Hà Trung, Thanh Hóa (Lần 1)
Đề thi thử THPT Quốc gia năm 2017 môn Hóa học
Đề thi thử THPT Quốc gia năm 2017 môn Hóa học trường THPT Hà Trung, Thanh Hóa (Lần 1) có đáp án là tài liệu tham khảo hữu ích dành cho các bạn học sinh lớp 12. Đây là đề thi thử đại học năm 2017 môn Hóa, giúp các bạn thử sức trước các kì thi sắp tới, ôn thi đại học khối A, B tốt hơn. Mời các bạn tham khảo.
Đề thi thử THPT Quốc gia năm 2017 môn Sinh học trường THPT Hà Trung, Thanh Hóa (Lần 1)
Đề thi thử THPT Quốc gia năm 2017 môn Vật lý trường THPT Hà Trung, Thanh Hóa (Lần 1)
Đề thi thử THPT Quốc gia năm 2017 môn Toán trắc nghiệm trường THPT Hà Trung, Thanh Hóa (Lần 1)
|
SỞ GIÁO DỤC & ĐÀO TẠO THANH HÓA TRƯỜNG THPT HÀ TRUNG Đề có 04 trang (40 câu trắc nghiệm) |
KỲ THI THỬ THPT QUỐC GIA LẦN THỨ I NĂM HỌC 2016-2017 Thời gian làm bài: 50 phút, không kể thời gian giao đề Ngày thi: 04/12/2016 |
||
|
|
Mã đề thi 302 |
||
Câu 1: Dãy gồm các ion cùng tồn tại được trong một dung dịch là
A. Al3+, PO43–, Cl–, Ba2+. B. K+, Ba2+, OH–, Cl–.
C. Ca2+, Cl–, Na+, CO32–. D. Na+, K+, OH–, HCO3–.
Câu 2: Cho các hợp kim sau: Cu–Fe (1); Zn–Fe (2); Fe–C (3); Al–Fe (4). Khi tiếp xúc với dung dịch chất điện li thì số lượng hợp kim mà trong đó Fe bị ăn mòn trước là
A. 1. B. 3. C. 4 D. 2.
Câu 3: Cho phản ứng: NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O. Khi cân bằng hệ số cân bằng nguyên tối giản của NaCrO2 là
A. 2. B. 1. C. 3. D. 4.
Câu 4: Tiến hành các thí nghiệm sau: (a) Cho Mg vào dung dịch Fe2(SO4)3 dư; (b) Sục khí Cl2 vào dung dịch FeCl2; (c) Dẫn khí H2 dư qua bột CuO đun nóng; (d) Cho Ba vào dung dịch CuSO4 dư; (e) Nhiệt phân AgNO3. Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
A. 5. B. 2. C. 4. D. 3.
Câu 5: Phát biểu nào sau đây sai?
A. Sản phẩm của phản ứng xà phòng hoá chất béo là axit béo và glixerol.
B. Số nguyên tử hiđro trong phân tử este đơn và đa chức luôn là một số chẵn.
C. Nhiệt độ sôi của este thấp hơn hẳn so với ancol có cùng phân tử khối.
D. Trong công nghiệp có thể chuyển hoá chất béo lỏng thành chất béo rắn.
Câu 6: Cho dung dịch A chứa a mol ZnSO4; dung dịch B chứa b mol AlCl3; dung dịch C chứa KOH.
Thí nghiệm 1: cho từ từ dung dịch C vào dung dịch A.
Thí nghiệm 2: cho từ từ dung dịch C vào dung dịch B.
Lượng kết tủa trong hai thí nghiệm được mô tả theo đồ thị (ở hình dưới)
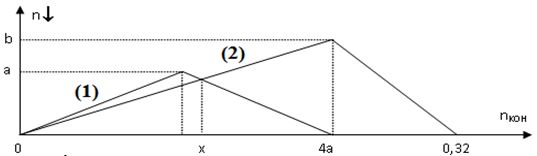
(1): đồ thị biểu diễn kết tủa ở thí nghiệm 1.
(2): đồ thị biểu diễn kết tủa ở thí nghiệm 2.
Tổng khối lượng kết tủa ở hai thí nghiệm khi dùng x mol KOH trong mỗi thí nghiệm là:
A. 8,496 gam. B. 10,620 gam. C. 25,488 gam. D. 11,286 gam.
Câu 7: Hòa tan hết 3 kim loại Mg, Al, Zn trong dung dịch HNO3 loãng, vừa đủ thu được dung dịch X không thấy có khí thoát ra. Cô cạn X được m gam muối khan trong đó phần trăm khối lượng của nguyên tố Oxi là 54%. Nung m gam muối khan nói trên tới khối lượng không đổi thu được 70,65 gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây?
A. 210. B. 200. C. 195. D. 185.
Câu 8: Chất nào sau đây thuộc loại đipeptit?
A. H2N-CH2-CONH-CH2-CONH-CH2-COOH. B. H2NCH2CH2CONH-CH2COOH.
C. H2NCH2CH2CONH-CH2 CH2COOH. D. H2N-CH2CONH-CH(CH3)-COOH.
Câu 9: Dung dịch A gồm: Ba2+; Ca2+; Mg2+; 0,3 mol NO3-; 0,5 mol Cl-. Để kết tủa hết tất cả các ion trong A cần dùng tối thiểu V (ml) dung dịch hỗn hợp gồm K2CO3 1M và Na2CO3 1,5M. Giá trị của V là
A. 320. B. 600. C. 300. D. 160.
Câu 10: Kim loại có những tính chất vật lý chung nào sau đây?
A. Tính dẻo, tính dẫn nhiệt, nhiệt độ nóng chảy cao.
B. Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
C. Tính dẫn điện, tính dẫn nhiệt, có khối lượng riêng lớn, có ánh kim.
D. Tính dẻo, có ánh kim, tính cứng.
Câu 11: Hợp chất hữu cơ A (chứa 3 nguyên tố C, H, O) chỉ chứa một loại nhóm chức. Cho 0,005 mol A tác dụng vừa đủ với 50 ml dung dịch NaOH (D = 1,2 g/ml) thu được dung dịch B. Làm bay hơi dung dịch B thu được 59,49 gam hơi nước và còn lại 1,48 gam hỗn hợp các chất rắn khan D. Nếu đốt cháy hoàn toàn chất rắn D thu được 0,795 gam Na2CO3; 0,952 lít CO2 (đktc) và 0,495 gam H2O. Nếu cho hỗn hợp chất rắn D tác dụng với dung dịch H2SO4 loãng dư, rồi chưng cất thì được 3 chất hữu cơ X, Y, Z chỉ chứa các nguyên tố C, H, O. Biết X, Y là 2 axit hữu cơ đơn chức và MZ < 125 Số nguyên tử H trong Z là
A. 12. B. 6. C. 8. D. 10.
Câu 12: Hỗn hợp X gồm Mg và MgO được chia thành 2 phần bằng nhau. Cho phần 1 tác dụng hết với dung dịch HCl thu được 3,136 lít khí (đktc); cô cạn dung dịch và làm khô thì thu được 14,25g chất rắn khan A.Phần trăm khối lượng của Mg trong hỗn hợp X là
A. 10,64%. B. 89,36%. C. 44,68%. D. 55,32%.
Câu 13: Trong số các loại tơ sau: tơ nitron, tơ visco, tơ nilon-6,6, tơ axetat. Có bao nhiêu loại tơ thuộc loại tơ nhân tạo?
A. 3. B. 2. C. 1. D. 4.
Câu 14: Để bảo vệ vỏ tàu biển, người ta thường dung phương pháp nào sau đây?
A. Dùng chất ức chế sự ăn mòn. B. Dùng phương pháp điện hóa.
C. Cách li kim loại với môi trường bên ngoài. D. Dùng hợp kim chống gỉ.
Câu 15: Cho các chất: etyl axetat, anilin, axit acrylic, phenol, glyxin, tripanmitin. Trong các chất này, số chất tác dụng được với dung dịch NaOH là
A. 2. B. 4. C. 3. D. 5.
Câu 16: Hòa tan hết 9,1 gam X gồm Mg, Al, Zn vào 500 ml dung dịch HNO3 4M thu được 0,448 lít N2 (đktc) và dung dịch Y. Chia Y thành 2 phần bằng nhau. Phần 1: Tác dụng vừa đủ với 530 ml dung dịch NaOH 2M được 2,9 gam kết tủa. Phần 2: Đem cô cạn thì được m gam chất rắn khan. Giá trị của m là
A. 38,40. B. 25,76. C. 33,79. D. 32,48.
Câu 17: Este X no, đơn chức, mạch hở, không có phản ứng tráng bạc. Đốt cháy 0,1 mol X rồi cho sản phẩm cháy hấp thụ hoàn toàn vào dung dịch nước vôi trong có chứa 0,22 mol Ca(OH)2 thì vẫn thu được kết tủa. Thuỷ phân X bằng dung dịch NaOH thu được 2 chất hữu cơ có số nguyên tử cacbon trong phân tử bằng nhau. Phần trăm khối lượng của oxi trong X là
A. 36,36%. B. 53,33%. C. 37,21%. D. 43,24%.
Câu 18: Cho các chất sau: (1) C6H5NH2; (2) C2H5NH2; (3) (C6H5)2NH; (4) (CH3)2NH; (5) NH3. Chiều giảm dần lực bazơ của các chất là
A. (4) > (2) > (5) > (3) > (1). B. (4) > (2) > (5) > (1) > (3).
C. (2) > (4) > (5) > (3) > (1). D. (5) > (4) > (1) > (2) > (3).
Câu 19: Dãy các ion xếp theo chiều giảm dần tính oxi hóa là
A. Ag+, Cu2+, Fe3+, Fe2+. B. Ag+, Fe3+, Cu2+, Fe2+.
C. Fe3+, Ag+, Cu2+, Fe2+. D. Fe3+, Cu2+, Ag+, Fe2
Câu 20: Hoà tan m gam bột nhôm bằng dung dịch HCl dư thu được 3,36 lít khí (ở đktc). Giá trị m là
A. 6,075. B. 2,7. C. 4,05. D. 3,6.
Câu 21: Biết cấu hình electron của Fe: 1s22 s22p63s23p63d64s2. Vị trí của Fe trong bảng tuần hoàn các nguyên tố hóa học là
A. Số thứ tự 26, chu kỳ 4, nhóm VIIIB. B. Số thứ tự 25, chu kỳ 4, nhóm IIB.
C. Số thứ tự 26, chu kỳ 4, nhóm IIA. D. Số thứ tự 26, chu kỳ 3, nhóm VIIIA.
Câu 22: Khí nào sau đây là tác nhân chủ yếu gây mưa axit?
A. N2. B. NH3. C. CH4. D. SO2.
Câu 23: Thuốc thử nào sau đây có thể dùng để phân biệt được các dung dịch: Glucozơ; glixerol; etanol và lòng trắng trứng?
A. dd NaOH. B. dd HNO3. C. dd AgNO3. D. Cu(OH)2/NaOH.
Câu 24: Khử C2H5COOCH3 bằng LiAlH4 thu được ancol là
A. C2H5OH. B. CH3CH2CH2OH và CH3OH.
C. C2H5OH và CH3OH. D. CH3CH2CH2OH và C2H5OH.
Câu 25: Khi xà phòng hóa tristearin ta thu được sản phẩm là
A. C15H31COOH và glixerol. B. C15H31COONa và etanol.
C. C17H35COONa và glixerol. D. C17H35COOH và glixerol.
Câu 26: Số đồng phân este đơn chức ứng với công thức phân tử C4H8O2 là
A. 3. B. 6. C. 4. D. 5.
Câu 27: Cho 7,28 gam bột Fe vào 200 ml dung dịch hỗn hợp gồm HCl 2M và KNO3 1M, sau phản ứng thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Dung dịch X hòa tan được tối m gam Cu. Giá trị của m là
A. 1,92. B. 1,20. C. 1,28. D. 0,64.
Câu 28: Saccarozơ và glucozơ đều có
A. phản ứng với Cu(OH)2 ở nhiệt độ thường tạo thành dung dịch xanh lam.
B. phản ứng với dung dịch NaCl.
C. phản ứng thuỷ phân trong môi trường axit.
D. phản ứng với AgNO3 trong dung dịch NH3, đun nóng.
Câu 29:Để phân biệt CO2 và SO2 người ta dùng thuốc thử là
A. dd BaCl2. B. dd Ca(OH)2 dư. C. dd nước brom. D. Quì tím.
Câu 30: Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M. Sau khi phản ứng kết thúc,thể tích khí CO2 thu được ở đktc là
A. 448 ml. B. 672 ml. C. 336 ml. D. 224 ml.
Câu 31: Thủy phân hoàn toàn 3,42 gam hỗn hợp X gồm saccarozơ và mantozơ thu được hỗn hợp Y. Biết rằng hỗn hợp Y làm mất màu vừa đủ 100 ml nước brom 0,15M. Nếu đem 3,42 gam hỗn hợp X cho phản ứng với lượng dư AgNO3 trong NH3 thì khối lượng Ag tạo ra là
A. 1,62 gam. B. 2.16 gam. C. 1,08 gam. D. 4,32 gam.
Câu 32: Cho 50 gam hỗn hợp X gồm Fe3O4, Cu, Mg tác dụng với dung dịch HCl dư, sau phản ứng được 2,24 lít H2 (đktc) và còn lại 18 gam chất rắn không tan. Phần trăm khối lượng Fe3O4 trong X là
A. 46,4. B. 59,2. C. 52,9. D. 25,92.
Câu 33: Đốt cháy hoàn toàn một lượng amin no đơn chức mạch hở X thu được 16,8 lit CO2 (đktc), 20,25 gam H2O và 3,5 gam N2 (đktc). CTPT của X là
A. C2H7N. B. C4H11N. C. C3H9N. D. CH5N.
Câu 34: Ba chất hữu cơ X, Y, Z (50 < MX < MY < MZ) đều chứa C, H, O. Hỗn hợp T gồm X, Y, Z trong đó nX = 4(nY + nZ). Đốt cháy hoàn toàn m gam T thu được 13,2 gam CO2. Mặt khác, m gam T phản ứng vừa đủ với 400 ml dung dịch KHCO3 0,1M. Cho m gam T phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 thu được 56,16 gam Ag. Phần trăn khối lượng của X trong T là
A. 32,54%. B. 47,90%. C. 74,52%. D. 79,16%.
Câu 35: Có bao nhiêu nguyên tố hóa học có cấu hình e lớp ngoài cùng là 4s1?
A. 2. B. 4. C. 1. D. 3.
Câu 36: Tên của hợp chất CH3-CH2-NH2 là
A. etylamin. B. đimetylamin. C. metylamin. D. phenylamin.
Câu 37: Đipeptit mạch hở X và tripeptit mạch hở Y đều được tạo nên từ một aminoaxit (no, mạch hở, trong phân tử chứa một nhóm –NH2 và một nhóm –COOH). Đốt cháy hoàn toàn 0,1 mol Y, thu được tổng khối lượng CO2và H2O bằng 54,9 gam. Đốt cháy hoàn toàn m (gam) X lượng CO2 sinh ra được hấp thụ hoàn toàn vào 600 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M sinh ra 11,82g kết tủa. Giá trị của m là
A. 1,6 và 6,4. B. 3,2 và1,6. C. 6,4. D. 1,6 và 8.
Câu 38: Nhúng một lá sắt vào dung dịch CuSO4, sau một thời gian lấy lá sắt ra cân nặng hơn so với ban đầu 0,2 gam, khối lượng đồng bám vào lá sắt là
A. 0,2 gam. B. 3,2 gam. C. 6,4 gam. D. 1,6 gam.
Câu 39: Thủy phân hoàn toàn m gam hỗn hợp A gồm peptit X và peptit Y (được trộn theo tỉ lệ mol 4:1) thu được 30 gam glyxin; 71,2 gam alanin và 70,2 gam valin. Biết tổng số liên kết peptit có trong 2 phân tử X và Y là 7. Giá trị nhỏ nhất của m là
A. 135. B. 151,6. C. 146,8. D. 145.
Câu 40: Tính chất hoá học chung của kim loại là
A. Tính lưỡng tính. B. Tính khử. C. Tính oxi hóa. D. Tính dẻo.
Đáp án đề thi thử THPT Quốc gia năm 2017 môn Hóa học
|
1 |
B |
11 |
C |
21 |
A |
31 |
C |
|
2 |
D |
12 |
B |
22 |
D |
32 |
A |
|
3 |
A |
13 |
B |
23 |
D |
33 |
C |
|
4 |
B |
14 |
B |
24 |
B |
34 |
C |
|
5 |
A |
15 |
D |
25 |
C |
35 |
D |
|
6 |
A |
16 |
C |
26 |
C |
36 |
A |
|
7 |
C |
17 |
A |
27 |
C |
37 |
A |
|
8 |
D |
18 |
B |
28 |
A |
38 |
D |
|
9 |
D |
19 |
B |
29 |
C |
39 |
D |
|
10 |
A |
20 |
B |
30 |
D |
40 |
B |

