Các phương pháp giải nhanh bài toán Hóa học
Phương pháp giải nhanh bài toán hóa học
Nhằm giúp các bạn học sinh giải quyết các bài tập trác nghiệm hóa học một cách nhanh chóng và hiệu quả, VnDoc.com xin giới thiệu tài liệu "Các phương pháp giải nhanh bài toán hóa học". Tài liệu ôn thi THPT Quốc Gia 2021 môn Hóa này sẽ giúp các em học sinh ôn thi đại học môn Hóa học với các phương pháp đơn giản đề giải nhanh bài toán, chắc chắn sẽ giúp các bạn có thêm nhiều kiến thức bổ ích để chuẩn bị trong các kỳ thi sắp tới. Mời các bạn cùng tham khảo chi tiết tại đây nhé.
- Phương pháp giải bài tập hidrocacbon thơm
- Phương pháp giải nhanh tính lưỡng tính của Nhôm hidroxit
- Tổng hợp phương pháp giải nhanh hóa vô cơ
Các phương pháp giải nhanh bài toán Hóa học vừa được VnDoc.com sưu tập và xin gửi tới bạn đọc cùng tham khảo. Bài viết được tổng hợp các phương pháp để giải nhanh các bài toán hóa học lớp 12 như phương pháp sơ đồ đường chéo, phương pháp bảo toàn khối lượng, phương pháp tăng giảm khối lượng, phương pháp bảo toàn nguyên tố... Các phương pháp đều có bài tập ví dụ kèm theo để giải thích và cách sử dụng phương pháp đó. Mời các bạn cùng tham khảo chi tiết và tải về tại đây nhé.
PHƯƠNG PHÁP SƠ ĐỒ ĐƯỜNG CHÉO
Với hình thức thi trắc nghiệm khách quan, trong một khoảng thời gian tương đối ngắn học sinh phải giải quyết một số lượng câu hỏi và bài tập khá lớn (trong đó bài tập toán chiếm một tỉ lệ không nhỏ). Do đó việc tìm ra các phương pháp giúp giải nhanh bài toán hóa học có một ý nghĩa quan trọng.
Bài toán trộn lẫn các chất với nhau là một dạng bài hay gặp trong chương trình hóa học phổ thông. Ta có thể giải bài tập dạng này theo nhiều cách khác nhau, song cách giải nhanh nhất là “phương pháp sơ đồ đường chéo”.
Nguyên tắc: Trộn lẫn 2 dung dịch:
Dung dịch 1: có khối lượng m1, thể tích V1, nồng độ C1 (C% hoặc CM), khối lượng riêng d1.
Dung dịch 2: có khối lượng m2, thể tích V2, nồng độ C2 (C2 > C1), khối lượng riêng d2.
Dung dịch thu được có m = m1 + m2, V = V1 + V2, nồng độ C (C1 < C < C2), khối lượng riêng d.
Sơ đồ đường chéo và công thức tương ứng với mỗi trường hợp là:
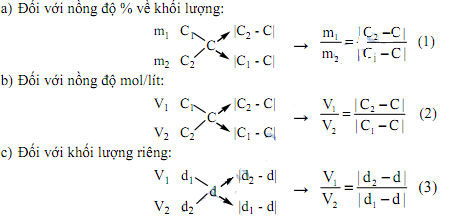
Khi sử dụng sơ đồ đường chéo ta cần chú ý:
- Chất rắn coi như dung dịch có C = 100%
- Dung môi coi như dung dịch có C = 0%
- Khối lượng riêng của H2O là d = 1 g/ml
Sau đây là một số ví dụ sử dụng phương pháp đường chéo trong tính toán pha chế dung dịch.
Dạng 1: Tính toán pha chế dung dịch
Ví dụ 1. Để thu được dung dịch HCl 25% cần lấy m1 gam dung dịch HCl 45% pha với m2 gam dung dịch HCl 15%. Tỉ lệ m1/m2 là:
A. 1:2 B. 1:3 C. 2:1 D. 3:1
Hướng dẫn giải:
Áp dụng công thức (1)
m1/m2 = |45 -25|/|15 -25| = 20/10 = 2/1
→ Đáp án C
Ví dụ 2. Để pha được 500 ml dung dịch nước muối sinh lí (C = 0,9%) cần lấy V ml dung dịch NaCl 3%. Giá trị của V là:
A. 150 B. 214,3 C. 285,7 D. 350
Hướng dẫn giải:
| Ta có sơ đồ: | 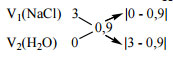 |
→ V1 = 0,9/(2,1 + 0,9) .500 = 150 (ml)
→ Đáp án A
Phương pháp này không những hữu ích trong việc pha chế các dung dịch mà còn có thể áp dụng cho các trường hợp đặc biệt hơn, như pha một chất rắn vào dung dịch. Khi đó phải chuyển nồng độ của chất rắn nguyên chất thành nồng độ tương ứng với lượng chất tan trong dung dịch.
(Còn tiếp)
Trên đây VnDoc.com vừa giới thiệu tới các bạn bài viết Các phương pháp giải nhanh bài toán Hóa học, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa học lớp 12. Mời các bạn cùng tham khảo thêm các môn Toán 12, Ngữ văn 12, tiếng Anh 12, đề thi học kì 1 lớp 12, đề thi học kì 2 lớp 12...
Mời bạn đọc cùng tham gia nhóm Tài liệu học tập lớp 12 của VnDoc.com để có thêm tài liệu học tập nhé.


