Dãy điện hóa của kim loại chi tiết đầy đủ
Dãy điện hóa kim loại
Dãy điện hóa của kim loại chi tiết đầy đủ được VnDoc biên soạn gửi tới bạn đọc là tài liệu chi tiết về dẫy điện hóa, giúp các bạn học sinh nắm được dãy điện hóa của kim loại cũng nhưu tính chất của dãy điện hóa từ đó vận dụng giải các dạng bài tập liên quan. Mời các bạn tham khảo.
I. Dãy điện hóa của kim loại là gì?
Dãy điện hóa của kim loại hay còn được biết đến với tên gọi khác là dãy hoạt động hóa học của kim loại. Đây là một dãy các kim loại được sắp xếp theo thứ tự nhất định. Cụ thể, thứ tự này được sắp xếp phụ thuộc vào mức độ hoạt động của kim loại. Mức độ này sẽ được xác định dựa vào khả năng tham gia phản ứng hóa học của kim loại này với các chất khác.
II. Ý nghĩa dãy điện hóa của kim loại
Các kim loại đứng phía trước sẽ có tính khử mạnh hơn kim loại đứng sau. Ngược lại, các kim loại đứng sau sẽ có tính oxi hóa mạnh hơn những kim loại đứng trước.
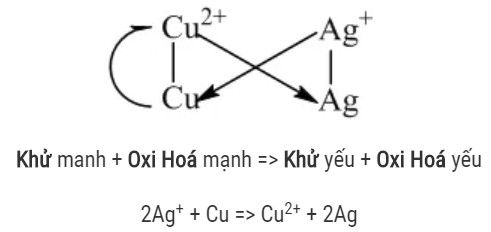
Ví dụ: Ag2++ Cu → Cu2++ Ag (kết tủa)
Quy tắc α cũng có những trường hợp ngoại lệ.
Thí dụ:
Các kim loại kiềm đầu dãy sẽ không khử kim loại. Mà ngược lại, chúng sẽ khử nước.
2K + 2H2O → 2KOH + H2
Các kim loại từ Mg đến trước Hidro, khi tác dụng với dung dịch axit sẽ tạo ra muối và giải phóng khí hidro.
Thí dụ:
Fe + 2HCl → FeCl2 + H2
Al, Fe, Cr sẽ thụ động với HNO3 đặc nguội và H2SO4 đặc nguội.
Các kim loại cuối dãy (Au, Pt,…) ko tác dụng được với axit.
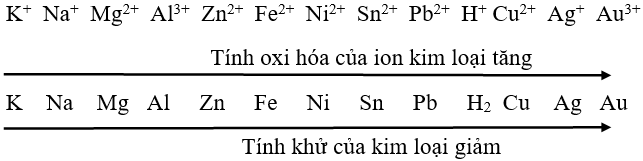
Dãy điện hóa của kim loại đầy đủ cho biết tính oxi hóa và tính khử của các chất
III. Xác định chiều của phản ứng oxi hóa – khử
Quy tắc α
Để viết đúng chiều của phản ứng oxi hóa – khử, người ta viết cặp oxi hóa – khử có thế điện cực chuẩn nhỏ ở bên trái, cặp oxi hóa – khử có thế điện cực chuẩn lớn hơn ở bên phải rồi viết phương trình theo quy tắc α
Xác định suất điện động chuẩn của pin điện hóa
Eopin = Eo (+) – Eo (−)
IV. Tính chất của kim loại dãy điện hóa của kim loại
Từ dãy điện hóa của kim loại đầy đủ, ta có thể xác định được tính chất của các chất trong dãy điện hóa. Vậy các kim loại nói chung có tính chất hóa học thế nào?
Tính chất hóa học nổi bật nhất của kim loại là tính khử. Công thức tổng quát như sau:
R → Rn++ ne (với 1≤n≤3).
1. Tác dụng với phi kim
Kim loại có thể tác dụng với phi kim để tạo ra muối. Các phi kim thường gặp như clo, oxi hay lưu huỳnh. Các muối tạo ra đều có điểm chung là sẽ kết tủa.
Thí dụ:
Tác dụng với clo: 2Fe + Cl2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
\(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
Tác dụng với oxi: 4Al + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
\(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
Tác dụng với lưu huỳnh: Hg + S → HgS
2. Tác dụng với dung dịch axit
Kim loại có thể tác dụng với dung dịch axit để tạo ra muối và giải phóng khí hoặc nước. Tuy nhiên, với những trường hợp ngoại lệ đã được nêu trong phần ý nghĩa của dãy điện hóa kim loại sẽ không có phản ứng với dung dịch axit.
Khi tác dụng với Dung dịch HCl, H2SO4 loãng thì kim loại khử H+ tạo thành H2
Thí dụ:
Zn + 2HCl → ZnCl2 + H2
Khi kim loại tác dụng với dung dịch HNO3, H2SO4 đặc: kim loại khử N+5, S+6 xuống số mức oxi hóa thấp hơn
Thí dụ:
3Zn + HNO3 → 3ZnSO4 + 2NO + 4H2O
trong đó, HNO3 loãng còn NO sinh ra ở dạng khí.
3. Tác dụng với nước
Phản ứng này sẽ đúng với kim loại nhóm IA và IIA. Sản phẩm được tạo thành sẽ là một dung dịch kiềm và khí hidro.
Thí dụ:
2Na + 2H2O → 2NaOH + H2 (khí)
4. Tác dụng với dung dịch muối
Đây là tính chất thể hiện việc kim loại mạnh hơn sẽ khử ion kim loại yếu hơn trong muối thành kim loại tự do. Sản phẩm được tạo thành sẽ là một muối mới và kim loại mới.
Ví dụ: Fe + CuSO4 → FeSO4 + Cu
V. Cách đọc dãy điện hóa dễ thuộc
Cách nhớ nhanh dãy điện hóa kim loại đang được nhiều bạn học sinh áp dụng đó là biến tấu thành một đoạn thơ.
K Na Ba Ca Mg Al Zn
Khi Nào Bà Con May Áo Dài
Fe Ni Sn Pb H
Phái Người Sang Phố Hỏi
Cu Hg Ag Pt Au
Cửa Hiệu Á Phi Âu.
............................................
Dãy điện hóa của kim loại chi tiết đầy đủ được VnDoc biên soạn cẩn thận, giúp bạn đọc có thêm tài liệu bổ ích về dãy điện hóa cũng như biết cách vận dụng ghi nhớ dãy điện hóa một cách nhanh và chính xác nhất. Các bạn có thể các em cùng tham khảo thêm một số tài liệu: Thi thpt Quốc gia môn Toán, Thi THPT Quốc gia môn Vật Lý,....
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu ôn tập THPT Quốc gia miễn phí trên Facebook: Tài liệu học tập lớp 12 Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu, đề thi mới nhất.



