Đề cương ôn tập tổng kết cuối năm môn Hóa học lớp 8
Đề cương ôn tập môn Hóa học lớp 8
Đề cương ôn tập tổng kết cuối năm môn Hóa học lớp 8 giúp các em học sinh lớp 8 luyện tập và củng cố kiến thức trước khi vào năm học mới hiệu quả. Mời các em học sinh lớp 8 tải bài tập hè môn Hóa học này về và ôn tập, chuẩn bị trước khi bắt đầu năm học mới.
ÔN TẬP TỔNG KẾT CUỐI NĂM HÓA 8
1: LÝ THUYẾT
CHƯƠNG 4: OXI KHÔNG KHÍ
I. TÍNH CHẤT CỦA OXI:
1) Tính chất vật lí:
Oxi là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí. Oxi hóa lỏng ở - 1830C. Oxi lỏng có màu xanh nhạt.
2) Tính chất hóa học:
Oxi là một phi kim khá hoạt động, tác dụng với kim loại, phi kim và nhiều hợp chất. Trong hợp chất oxi có hóa trị II.
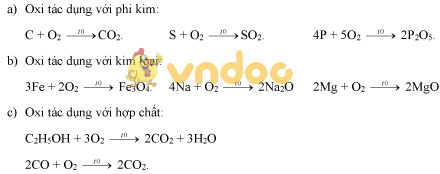
II. SỰ OXI HÓA:
Sự tác dụng của oxi với một chất là sự oxi hóa.
III. PHẢN ỨNG HÓA HỢP:
Định nghĩa: Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
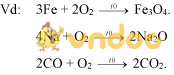
IV. OXIT:
1. Định nghĩa: Oxit là hợp chất hai nguyên tố trong đó có một nguyên tố oxi.
Vd: CO2, CuO, SO2, Na2O, MgO
2. Phân loại:
Chia làm 2 loại chính
a) Oxit axit:
Thường là oxit của phi kim và tương ứng với một axit.
Vd: CO2 tương ứng với axit H2CO3.
SO3 tương ứng với axit H2SO4.
P2O5 tương ứng với axit H3PO4.
b) Oxit bazơ:
Là oxit của kim loại và tương ứng với một bazơ.
Vd: Na2O tương ứng với bazơ NaOH
CuO tương ứng với bazơ Cu(OH)2.
Fe2O3 tương ứng với bazơ Fe(OH)3.
3) Cách gọi tên:
Tên oxit = tên nguyên tố + oxit.
- Kim loại có nhiều hóa trị
Tên gọi = tên kim loại (hóa trị) + oxit
- Nếu phi kim có nhiều hóa trị
Tên gọi = Tên phi kim + oxit
(Kềm theo tiền tố chỉ số nguyên tử)
V. ĐIỀU CHẾ KHÍ OXI:
1) Điều chế khí oxi trong phòng thí nghiệm:
Đung nóng KMnO4, KClO3.
![]()
![]()
2) Sản xuất oxi trong công nghiệp:
- Chưng cất phân đoạn không khí lỏng, N2(-1960C), O2(-1830C)
- Điện phân nước
![]()
VI. PHẢN ỨNG PHÂN HỦY:
Định nghĩa: Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
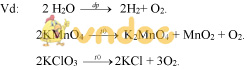
VII. THÀNH PHẦN CỦA KHÔNG KHÍ:
- Không khí là hỗn hợp nhiều chất khí.
- Thành phần theo thể tích của không khí là:
- 21% khí O2.
- 78% khí N2.
- 1% các khí khác.
VIII. SỰ CHÁY VÀ SỰ OXI HÓA CHẬM:
1) Sự cháy và sự oxi hóa chậm:
Sự cháy: Là sự oxi hóa có toả nhiệt và phát sáng.
Ví dụ: Đốt than...
Sự oxi hóa chậm: Là sự oxi hóa có toả nhiệt nhưng không phát sáng.
Ví dụ: Thanh sắt để ngoài nắng....
2) Điều kiện phát sinh và các biện pháp dập tắt sự cháy
Các điều kiện phát sinh sự cháy:
- Chất phải nóng đến nhiệt độ cháy.
- Phải có đủ oxi cho sự cháy.



