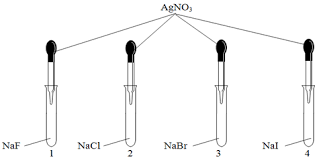
Nguyên tố halogen dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật trí tuệ
Nguyên tố halogen dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật trí tuệ là:
Iodine dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật trí tuệ.