Phản ứng thu nhiệt
Phản ứng thu nhiệt có
Phản ứng thu nhiệt có ΔH > 0.
Vndoc.com xin gửi tới bạn đọc Đề thi khảo sát chất lượng Hóa 10 tháng 1, cùng nhau luyện tập và xem kết quả nha!
Phản ứng thu nhiệt
Phản ứng thu nhiệt có
Phản ứng thu nhiệt có ΔH > 0.
Xác định hợp chất trong đó iron có số oxi hóa +2
Iron có số oxi hóa +2 trong hợp chất nào sau đây?
Trong hợp chất FeSO4 iron có số oxi hóa +2.
Trong các hợp chất Fe2O3, FeCl3, Fe(OH)3, iron có số oxi hóa +3.
Nguyên tử có khuynh hướng đạt cấu hình e bền của khí hiếm neon
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
Oxygen có cấu hình electron là: 1s22s22p4.
Oxygen có khuynh hướng nhận thêm 2 electron để đạt được cấu hình electron bền vững giống với khí hiếm neon (Ne).
Sự hình thành phân tử CaO
Phân tử BaO được hình thành do
Phân tử BaO được hình thành do sự kết hợp giữa ion Ba2+ và ion O2–.
Xác định liên kết hóa học giữa nguyên tử X và nguyên tử Y
Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
X có 1 electron lớp ngoài cùng, electron cuối cùng điền vào phân lớp 4s
→ X thuộc chu kì 4, nhóm IA.
X có xu hướng dễ dàng nhường 1 electron để tạo thành ion: X → X+ + 1e.
Y có 7 electron lớp ngoài cùng, electron cuối cùng điền vào phân lớp 2p
→ Y thuộc chu kì 2, nhóm VIIA.
Y có xu hướng dễ dàng nhận 1 electron để tạo thành ion: Y + 1e → Y–.
Hai ion được tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử XY ⇒ Liên kết hoá học giữa nguyên tử X và nguyên tử Y là liên kết ion.
Phản ứng đốt cháy than
Phản ứng than cháy trong không khí: C + O2 CO2 là phản ứng
Phản ứng than cháy trong không khí là phản ứng tỏa nhiệt
Lí do H2O có nhiệt độ sôi và độ tan trong nước tốt hơn CH4
H2O có nhiệt độ sôi và độ tan trong nước tốt hơn CH4 vì lí do nào sau đây?
H2O có nhiệt độ sôi và độ tan trong nước tốt hơn CH4 vì H2O có liên kết hydrogen, còn CH4 thì không có.
Chất có liên kết cộng hóa trị phân cực và không phân cực
Chất vừa có liên kết cộng hóa trị phân cực, vừa có liên kết cộng hóa trị không phân cực là
Phân tử C2F6 vừa có liên kết cộng hóa trị phân cực (liên kết giữa C và F), vừa có liên kết công hóa trị không phân cực (liên kết giữa C với C).
Xác định phản ứng là phản ứng oxi hóa – khử
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
Phản ứng 2Mg + O2 2MgO là phản ứng oxi hóa khử do có sự thay đổi số oxi hóa của nguyên tử Mg và O.
Xác định chất bền nhất về mặt nhiệt độ ở đkc
= –74,9 kJ.mol–1 < 0 ⇒ CH4(g) bền nhất ở điều kiện chuẩn.
Xác định công thức oxide cao nhất của R
Nguyên tử R có cấu hình electron: 1s22s22p63s23p5. Công thức oxide cao nhất của R là
Từ cấu hình electron của R ta thấy nguyên tử R có 7 lectron lớp ngoài cùng
⇒ Công thức oxide cao nhất của R là R2O7.
Độ âm điện đặc trưng cho
Độ âm điện đặc trưng cho khả năng
Độ âm điện đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.
Số chu kì trong bảng hệ thống tuần hoàn
Số chu kì trong bảng hệ thống tuần hoàn là
Số chu kì trong bảng hệ thống tuần hoàn là 7.
Công thức cấu tạo không đủ electron theo quy tắc octet
Công thức cấu tạo nào sau đây không đủ electron theo quy tắc octet?
Công thức  không đủ electron theo quy tắc octet vì B chưa đủ 8 electron lớp ngoài cùng.
không đủ electron theo quy tắc octet vì B chưa đủ 8 electron lớp ngoài cùng.
Công thức đúng:

Các quá trình xảy ra trong phản ứng
Cho phản ứng hóa học: Zn + CuSO4 → ZnSO4 + Cu. Trong phản ứng trên xảy ra
Trong phản ứng: Zn + CuSO4 → ZnSO4 + Cu xảy ra các quá trình:
Đây là quá trình Zn nhường electron ⇒ quá trình oxi hóa hay sự oxi hóa Zn.
Đây là quá trình Cu2+ nhận electron ⇒ quá trình khử hay là sự khử Cu2+.
Xác định phản ứng có thể tự xảy ra
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Phản ứng giữa Zn và dung dịch H2SO4 có thể tự xảy ra ở điều kiện thường
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Các phản ứng còn lại cần cung cấp nhiệt thì phản ứng mới xảy ra.
Xác định số proton X, Y
X và Y là hai nguyên tố thuộc cùng một chu kỳ và nằm ở hai nhóm A liên tiếp (ZX < ZY). Biết tổng số proton trong hạt nhân hai nguyên tử X và Y là 31. Số proton của X, Y lần lượt là
Gọi số proton của nguyên tử nguyên tố X và Y lần lượt là P1, P2.
Theo bài ra ta có: P1 + P2 = 31 (1)
Do X và Y là hai nguyên tố thuộc cùng một chu kỳ và nằm ở hai nhóm A liên tiếp (ZX < ZY)
⇒ P1 + 1 = P2 (2)
Từ (1) và (2) ⇒ P1 = 15, P2 = 16.
Tìm phát biểu đúng
Cho phản ứng sau: 2H2(g) + O2(g) → 2H2O(g) = –483,64 kJ. Phát biểu nào sau đây đúng?
- Phản ứng có = –483,64 kJ < 0 ⇒ Phản ứng tỏa nhiệt.
- Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
⇒ Phát biểu đúng là: Nhiệt tạo thành chuẩn của H2O là –241,82 kJ/mol.
Xác định nguyên tử khối trung bình của chlorine
Tỉ lệ phần trăm số nguyên tử các đồng vị tự nhiên của chlorine (Cl) được xác định theo phổ khối lượng sau:
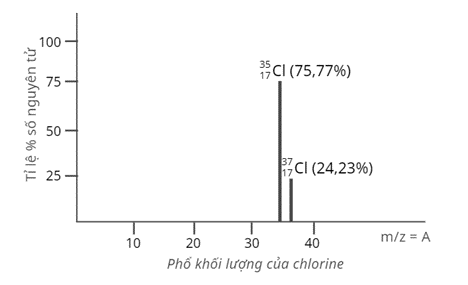
Nguyên tử khối trung bình của Cl là
Nguyên tử khối trung bình của Cl là:
Tính số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại
Cho các phân tử: H2O, NH3, HF, H2S, CO2, HCl. Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là
Chỉ có H2O, NH3, HF mới tạo được liên kết hydrogen với các phân tử cùng loại; còn H2S, CO2, HCl thì không.
Ở mỗi phát biểu, chọn đúng hoặc sai
Nguyên tố K có số hiệu nguyên tử là 19. Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Số electron ở vỏ nguyên tử của nguyên tố K là 19. Đúng || Sai
(b) Vỏ của nguyên tử K có 4 lớp eletron và ngoài cùng có 2 electron. Sai || Đúng
(c) Hạt nhân của nguyên tử nguyên tố K có 19 proton. Đúng || Sai
(d) Nguyên tố K là một phi kim. Sai || Đúng
Nguyên tố K có số hiệu nguyên tử là 19. Ở mỗi phát biểu sau, hãy chọn đúng hoặc sai:
(a) Số electron ở vỏ nguyên tử của nguyên tố K là 19. Đúng || Sai
(b) Vỏ của nguyên tử K có 4 lớp eletron và ngoài cùng có 2 electron. Sai || Đúng
(c) Hạt nhân của nguyên tử nguyên tố K có 19 proton. Đúng || Sai
(d) Nguyên tố K là một phi kim. Sai || Đúng
Cấu hình electron của nguyên tử nguyên tố K (Z = 19) là: 1s22s22p63s23p64s1.
(a) đúng.
(b) sai. Vỏ của nguyên tử K có 4 lớp eletron và ngoài cùng có 1 electron.
(c) đúng.
(d) sai. Nguyên tử nguyên tố K có 1 electron ở lớp ngoài cùng ⇒ nguyên tố K là một phi kim.
Ở mỗi ý a), b), c), d) chọn đúng hoặc sai
Ở mỗi ý a), b), c), d) hãy chọn đúng hoặc sai.
N2(g) + O2(g) → 2NO(g) ![]() = +180 kJ
= +180 kJ
a) Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp. Sai || Đúng
b) Phản ứng tỏa nhiệt. Sai || Đúng
c) Phản ứng xảy ra thuận lợi ở điều kiện thường. Sai || Đúng
d) Phản ứng hóa học xảy ra có sự hấp thụ năng nhiệt năng từ môi trường. Đúng || Sai
Ở mỗi ý a), b), c), d) hãy chọn đúng hoặc sai.
N2(g) + O2(g) → 2NO(g) ![]() = +180 kJ
= +180 kJ
a) Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp. Sai || Đúng
b) Phản ứng tỏa nhiệt. Sai || Đúng
c) Phản ứng xảy ra thuận lợi ở điều kiện thường. Sai || Đúng
d) Phản ứng hóa học xảy ra có sự hấp thụ năng nhiệt năng từ môi trường. Đúng || Sai
Phản ứng có = +180 kJ nên là phản ứng thu nhiệt, hấp thu nhiệt từ môi trường. Phản ứng xảy ra ở nhiệt độ cao.
Vậy:
a) sai.
b) sai.
c) sai.
d) đúng.
Ở mỗi ý a), b), c), d) chọn đúng hoặc sai
Sự đốt cháy nhiên liệu trong động cơ sinh ra năng lượng và năng lượng này sinh ra công có ích cho động cơ hoạt động.
a) Nhiên liệu được đốt cháy trong động cơ là quá trình oxi hóa. Đúng || Sai
b) Vai trò của oxygen là chất oxi hóa. Đúng || Sai
c) Khí thải của động cơ chỉ có khí CO2 và hơi nước. Sai || Đúng
d) Đưa thêm hợp chất có chứa chì vào xăng để làm giảm ô nhiễm môi trường. Sai || Đúng
Sự đốt cháy nhiên liệu trong động cơ sinh ra năng lượng và năng lượng này sinh ra công có ích cho động cơ hoạt động.
a) Nhiên liệu được đốt cháy trong động cơ là quá trình oxi hóa. Đúng || Sai
b) Vai trò của oxygen là chất oxi hóa. Đúng || Sai
c) Khí thải của động cơ chỉ có khí CO2 và hơi nước. Sai || Đúng
d) Đưa thêm hợp chất có chứa chì vào xăng để làm giảm ô nhiễm môi trường. Sai || Đúng
a) đúng.
b) đúng.
c) sai. Bên cạnh sự đốt cháy nhiên liệu để sinh ra năng lượng cho xe hoạt động còn có sự đốt cháy các tạp chất trong nhiên liệu như lưu huỳnh hay sự đốt cháy khí N2 (có trong không khí) tạo ra các khí như CO2, NO, NO2...
d) sai. Lượng chì trong xăng cao là nguyên nhân gây ô nhiễm không khí.
Ở mỗi phát biểu, hãy chọn đúng hoặc sai
Ở mỗi phát biểu sau về liên kết cộng hóa trị, hãy chọn đúng hoặc sai:
(a) Liên kết cộng hóa trị không cực chỉ được tạo nên từ hai nguyên tử giống hệt nhau. Sai || Đúng
(b) Liên kết cộng hóa trị có cực được tạo thành giữa hai nguyên tử có 0,4 ≤ Δx < 1,7. Đúng || Sai
(c) Hiệu độ âm điện giữa hai nguyên tử lớn thì phân tử phân cực yếu. Sai || Đúng
(d) Trong liên kết cộng hóa trị, cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn. Đúng || Sai
Ở mỗi phát biểu sau về liên kết cộng hóa trị, hãy chọn đúng hoặc sai:
(a) Liên kết cộng hóa trị không cực chỉ được tạo nên từ hai nguyên tử giống hệt nhau. Sai || Đúng
(b) Liên kết cộng hóa trị có cực được tạo thành giữa hai nguyên tử có 0,4 ≤ Δx < 1,7. Đúng || Sai
(c) Hiệu độ âm điện giữa hai nguyên tử lớn thì phân tử phân cực yếu. Sai || Đúng
(d) Trong liên kết cộng hóa trị, cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn. Đúng || Sai
(a) sai. Liên kết cộng hóa trị không phân cực có tạo nên từ hai nguyên tử nguyên tố khác nhau.
Ví dụ: CH4.
(b) đúng.
(c) sai. Hiệu độ âm điện giữa hai nguyên tử càng lớn thì phân tử phân cực càng mạnh.
(d) đúng.
Viết cấu hình e nguyên tử, cho biết số e lớp ngoài cùng và tính chất
Viết cấu hình electron nguyên tử nguyên tố có số hiệu sau, cho biết số electron lớp ngoài cùng và tính chất của nguyên tố là kim loại, phi kim hay khí hiếm?
a) X (Z = 17).
b) Y (Z = 10).
Viết cấu hình electron nguyên tử nguyên tố có số hiệu sau, cho biết số electron lớp ngoài cùng và tính chất của nguyên tố là kim loại, phi kim hay khí hiếm?
a) X (Z = 17).
b) Y (Z = 10).
a) X (Z = 17):
- Cấu hình electron: 1s22s22p63s23p5
- Số electron lớp ngoài cùng là: 7.
- X là phi kim.
b) Y (Z = 10):
- Cấu hình electron1s22s22p6.
- Số electron lớp ngoài cùng là: 8.
- Y là khí hiếm
Lập phương trình hóa học của phản ứng oxi hóa khử
Lập phương trình hóa học của phản ứng oxi hóa - khử sau theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử.
FeCl3 + H2S → FeCl2 + S + HCl
Lập phương trình hóa học của phản ứng oxi hóa - khử sau theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử.
FeCl3 + H2S → FeCl2 + S + HCl
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố:
Thăng bằng electron:
Vậy phương trình phản ứng đã cân bằng là:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Xác định nguyên tố R
Oxide cao nhất của một nguyên tố là RO3. Nó có trong thành phần của oleum, được sử dụng trong sản xuất nhiều chất nổ. Trong hợp chất khí của R với hydrogen có 5,88% hydrogen về khối lượng. Xác định nguyên tố R.
Oxide cao nhất của một nguyên tố là RO3. Nó có trong thành phần của oleum, được sử dụng trong sản xuất nhiều chất nổ. Trong hợp chất khí của R với hydrogen có 5,88% hydrogen về khối lượng. Xác định nguyên tố R.
Oxide cao nhất của một nguyên tố là RO3 → hợp chất khí của R với hydrogen là RH2.
Theo bài ra, trong hợp chất RH2 có 5,88% hydrogen:
⇒ R = 32
Vậy nguyên tố R là lưu huỳnh.
Xác định biến thiên enthalpy của phản ứng
Cho enthalpy tạo thành chuẩn của các chất tương ứng trong phương trình
| Chất | SO2(g) | SO3(l) |
| |
–296,8 | –441,0 |
Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
SO2(g) + ![]() O2(g) → SO3(l)
O2(g) → SO3(l)
Cho enthalpy tạo thành chuẩn của các chất tương ứng trong phương trình
| Chất | SO2(g) | SO3(l) |
| |
–296,8 | –441,0 |
Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
SO2(g) + ![]() O2(g) → SO3(l)
O2(g) → SO3(l)
=
(SO3(l)) – [
(SO2(g)) +
(SO3(l))]
= –441,0 – (–296,8 + 0)
= –144,2 kJ
Biểu diễn sự tạo thành ion và liên kết ion trong phân tử MgO, CaCl2
Biểu diễn sự tạo thành ion và liên kết ion trong phân tử MgO, CaCl2.
Biểu diễn sự tạo thành ion và liên kết ion trong phân tử MgO, CaCl2.
- MgO:
Mg → Mg2+ + 2e
O2+ + 2e → O
- CaCl2:
Ca → Ca2+ + 2e
Cl + 1e → Cl–
Ca2+ + 2Cl– → CaCl2
Tính m và số mol HNO3 đã bị khử
Khi cho m gam Mg tác dụng với dung dịch HNO3 thu được dung dịch X chứa 2 muối trong đó có NH4NO3 và 0,4958 lít khí N2O duy nhất (đkc). Cô cạn dung dịch X thu được 21,92 gam muối khan. Tính m và số mol HNO3 đã bị khử.
Khi cho m gam Mg tác dụng với dung dịch HNO3 thu được dung dịch X chứa 2 muối trong đó có NH4NO3 và 0,4958 lít khí N2O duy nhất (đkc). Cô cạn dung dịch X thu được 21,92 gam muối khan. Tính m và số mol HNO3 đã bị khử.
nN2O = 0,02 mol
Ta có sơ đồ phản ứng:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + N2O + H2O
Gọi số mol Mg(NO3)2 và NH4NO3 lần lượt là x, y ta có:
148x + 80y = 21,92 (1)
Quá trình nhường nhận electron:
| | |
| mol: x → 2x | mol: 0,16 ← 0,02 |
| | |
| mol: 8y ← y |
Bảo toàn số mol electron: 2x = 0,16 + 8y (2)
Giải hệ (1) và (2) ta có x = 0,14, y = 0,015
⇒ m = 0,14.24 = 3,36
Bảo toàn nguyên tố N:
nHNO3 = 2nMg(NO3)2 + 2nNH4NO3 + 2nN2O
= 0,14.2 + 0,015.2 + 0,02.2
= 0,35 (mol)
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:

