Đề thi thử THPT Quốc gia năm 2017 môn Hóa học trường THPT Phan Chu Trinh, Phú Yên
Đề thi thử THPT Quốc gia năm 2017 môn Hóa học
Đề thi thử THPT Quốc gia năm 2017 môn Hóa học trường THPT Phan Chu Trinh, Phú Yên gồm 40 câu trắc nghiệm có đáp án đi kèm, bám sát cấu trúc đề thi Bộ giáo dục, giúp các bạn ôn thi Đại học môn Hóa, luyện thi THPT Quốc gia môn Hóa hiệu quả.
Đề thi thử THPT Quốc gia năm 2017 môn Hóa học trường THPT Lê Văn Thịnh, Bắc Ninh
Đề thi thử THPT Quốc gia năm 2017 môn Hóa học trường THPT Lương Tài 2, Bắc Ninh (Lần 1)
|
TRƯỜNG PHAN CHU TRINH ĐỀ THI THỬ |
KỲ THI TRUNG HỌC PHỔ THÔNG QUỐC GIA NĂM 2017 Bài thi: Khoa học tự nhiên - Môn: HÓA HỌC Thời gian làm bài: 50 phút, không kể thời gian phát đề |
Cho biết nguyên tử khối (theo đvC) của các nguyên tố: Be = 9; C = 12; N = 14; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Mn = 55; Fe = 56; Cu = 64; Zn = 65; Br = 80; Rb = 85; Sr = 88; Ag = 108; Sn = 119; Cs = 133; Ba = 137; Pb = 207.
Câu 1: Phương pháp chung để điều chế các kim loại Na, Ca, Al trong công nghiệp là
A. thủy luyện. B. điện phân dung dịch.
C. nhiệt luyện. D. điện phân nóng chảy.
Câu 2: Trong ăn mòn điện hóa học xảy ra đồng thời
A. Sự khử cực ở âm, sự hòa tan ở cực dương
B. Sự oxi hóa ở cực dương, sự khử ở cực âm
C. Sự oxi hóa ở cực âm, sự khử ở cực dương
D. Sự oxi hóa ở cực dương, sự kết tủa ở cực âm
Câu 3: Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
A. W. B. Cr. C. Pb. D. Hg.
Câu 4: Cho dãy các kim loại: Li, Na, Al, Ca, Sr. Số kim loại kiềm trong dãy là
A. 2. B. 4. C. 1. D. 3.
Câu 5: Cho các hợp kim sau: Al – Zn (1); Fe – Zn (2); Zn – Cu (3); Mg – Zn (4). Khi tiếp xúc với dung dịch axit H2SO4 loãng thì các hợp kim mà trong đó Zn bị ăn mòn điện hóa học trước là
A. (2), (3) và (4). B. (3) và (4). C. (1), (2) và (3). D. (2) và (3).
Câu 6. Phản ứng không thể xảy ra là
A. Fe với dung dịch FeCl2. B. Fe với dung dịch FeCl3.
C. Fe với dung dịch Cu(NO3)2. D. Fe với dung dịch HNO3 đặc nóng.
Câu 7. Thêm từ từ dung dịch H2SO4 đến dư vào dung dịch K2CrO4 được dung dịch X, sau đó thêm từ từ dung dịch NaOH đến dư vào dung dịch X. Sự chuyển màu của dung dịch là
A. từ vàng sang da cam, sau đó từ da cam sang vàng.
B. từ không màu sang da cam, sau đó từ da cam sang vàng.
C. từ da cam sang vàng sau đó từ vàng sang da cam.
D. từ không màu sang vàng, sau đó từ vàng sang da cam.
Câu 8: Phát biểu nào sau đây không đúng?
A. O3 có tính oxi hóa mạnh hơn O2.
B. Muối AgI không tan trong nước, muốn AgF tan trong nước.
C. Na2CO3 là nguyên liệu quan trọng trong công nghiệp sản xuất thủy tinh.
D. Các nguyên tố mà nguyên tử có 1, 2, 3, 4 electron lớp ngoài cùng đều là kim loại
Câu 9: Trong phân tử của cacbohyđrat luôn có
A. nhóm chức axit. B. nhóm chức xeton.
C. nhóm chức ancol. D. nhóm chức anđehit.
Câu 10: Trong công nghiệp thực phẩm, để tạo hương dứa cho bánh kẹo người ta dùng este X có công thức cấu tạo CH3CH2COOC2H5. Tên gọi của X là
A. propyl axetat. B. metyl propionat.
C. metyl axetat. D. etyl propionat.
Câu 11: Phát biểu không đúng là:
A. Trong dung dịch, H2N-CH2-COOH còn tồn tại ở dạng ion lưỡng cực H3N+-CH2-COO-.
B. Aminoaxit là hợp chất hữu cơ tạp chức, phân tử chứa đồng thời nhóm amino và nhóm cacboxyl.
C. Hợp chất H2N-CH2-COOH3N-CH3 là este của glyxin (hay glixin).
D. Aminoaxit là những chất rắn, kết tinh, tan tốt trong nước và có vị ngọt.
Câu 12: Trong số các chất: tinh bột, xenlulozơ, saccarozơ, tripeptit, glucozơ, amoniaxetat. Số chất có thể tham gia phản ứng thủy phân:
A. 3 B. 5 C. 4 D. 6
Câu 13: Cho hỗn hợp gồm Al và Zn vào dung dịch AgNO3. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X chỉ chứa một muối và phần không tan Y gồm hai kim loại. Hai kim loại trong Y và muối trong X là
A. Zn, Ag và Zn(NO3)2. B. Al, Ag và Al(NO3)3.
C. Al, Ag và Zn(NO3)2. D. Zn, Ag và Al(NO3)3.
Câu 14: Cho các hợp chất của sắt sau: FeO, FeCO3, Fe2O3, Fe3O4, Fe(OH)2, Fe(OH)3, Fe(NO3)3; FeSO4; FeS lần lượt tác dụng với dung dịch axit HNO3 đặc đun nóng thì số trường hợp xảy ra phản ứng oxi hóa khử là
A. 5. B. 6. C. 4. D. 7.
Câu 15: Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Sục khí Cl2 dư vào dung dịch FeSO4.
(c) Cho hỗn hợp KHSO4 và KHCO3 (tỉ lệ mol 1 : 1) vào nước.
(d) Cho hỗn hợp Cu và Fe2O3 (tỉ lệ mol 1 : 1) vào dung dịch HCl dư.
(e) Cho hỗn hợp Fe(NO3)2 và AgNO3 (tỉ lệ mol 1 : 1) vào nước.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được hai muối là
A. 5. B. 3. C. 2. D. 4.
Câu 16: Thực hiện các thí nghiệm sau:
(a) Nhiệt phân AgNO3 (b) Nung FeS2 trong không khí
(c) Nhiệt phân KNO3 (d) Cho dung dịch CuSO4 vào dung dịch NH3 (dư)
(e) Cho Fe vào dung dịch CuSO4 (g) Cho Zn vào dung dịch FeCl3 (dư)
(h) Nung Ag2S trong không khí (i) Cho Ba vào dung dịch CuSO4 (dư)
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là
A. 3 B. 5 C. 6 D. 4
Câu 17: Có các dung dịch riêng biệt không dán nhãn: NH4Cl , AlCl3, FeCl3, Na2SO4, (NH4)2SO4, NaCl. Thuốc thử cần thiết để nhận biết tất cả các dung dịch trên là dung dịch
A. BaCl2. B. NaHSO4. C. Ba(OH)2. D. NaOH.
Câu 18: Bốn kim loại Na; Al; Fe và Cu được ấn định không theo thứ tự X, Y, Z, T biết rằng: X; Y được điều chế bằng phương pháp điện phân nóng chảy X đẩy được kim loại T ra khỏi dung dịch muối Z tác dụng được với dung dịch H2SO4 loãng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội. X, Y, Z, T theo thứ tự là:
A. Al; Na; Cu; Fe B. Na; Fe; Al; Cu C. Na; Al; Fe; Cu D. Al; Na; Fe; Cu
Câu 19: Cho sơ đồ: Tinh bột → A1 → A2 → A3 → A4 → CH3COOC2H5. A1, A2, A3, A4 có CTCT thu gọn lần luợt là
A. C6H12O6, C2H5OH, CH3CHO, CH3COOH.
B. C12H22O11, C2H5OH, CH3CHO, CH3COOH.
C. glicozen, C6H12O6, CH3CHO, CH3COOH.
D. C12H22O11, C2H5OH, CH3CHO, CH3COOH.
Câu 20: Cho các chất:HCOOCH3 (A); CH3COOC2H5 (B); CH3COOCH=CH2. Có thể dùng thuốc thử nào sau đây để phân biệt các chất trên:
A. dung dịch NaOH. B. dung dịch Br2 và dung dịch AgNO3/NH3
C. dung dịch AgNO3/NH3 D. dung dịch Br2
Câu 21: Số đồng phân cấu tạo của amin bậc một có cùng công thức phân tử C4H11N là
A. 4. B. 2. C. 5. D. 3.
Câu 22: Đun nóng chất H2N-CH2-CONH-CH(CH3)-CONH-CH2-COOH trong dung dịch HCl (dư), sau khi các phản ứng kết thúc thu được sản phẩm là:
A. H3N+-CH2-COOHCl-, H3N+-CH2-CH2-COOHCl-.
B. H2N-CH2-COOH, H2N-CH2-CH2-COOH.
C. H3N+-CH2-COOHCl-, H3N+-CH(CH3)-COOHCl-.
D. H2N-CH2-COOH, H2N-CH(CH3)-COOH.
Câu 23: Số nhận xét đúng
1. Saccarozơ không tạo kết tủa khi cho vào dung dịch AgNO3 trong NH3
2. Tơ poliamit kém bền trong các môi trường axit và bazơ
3. Tơ xenlulozơ axetat thuộc loại tơ hóa học .
4. Sản phẩm của sự thủy phân tính bột luôn là glucozơ
5. Dung dịch thu được khi thủy phân tinh bột hoàn toàn luôn có phản ứng tráng bạc
6. Xenlulozơ không tạo hợp chất màu xanh tím với iot
7. Quá trình quang hợp cây xanh có tạo thành glucozơ
A. 7 B. 5 C. 4 D. 8
Câu 24: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 8,96 lít. B. 17,92 lít. C. 6,72 lít. D. 11,2 lít.
Câu 25: Cho 15 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl (dư). Sau khi phản ứng xảy ra hoàn toàn, thu được 4,48 lít khí H2 (đktc) và m gam kim loại không tan. Giá trị của m là
A. 2,0 gam. B. 8,5 gam. C. 2,2 gam. D. 6,4 gam.
Câu 26: Hỗn hợp X gồm Mg, MgO, Ca và CaO. Hòa tan 10,72 gam X vào dung dịch HCl vừa đủ thu được 3,248 lít khí (đktc) và dung dịch Y. Trong Y có 12,35 gam MgCl2 và m gam CaCl2. Giá trị m là:
A. 33,3. B. 13,32. C. 15,54. D. 19,98.
Câu 27: Hòa tan hoàn toàn 5,6 gam Fe trong dung dịch HNO3 loãng (dư), thu được dung dịch có chứa m gam muối và khí NO (sản phẩm khử duy nhất). Giá trị của m là
A. 24,2 gam. B. 18,0 gam. C. 42,2 gam. D. 21,1 gam.
Câu 28: Thuỷ phân hoàn toàn 3,42 gam saccarozơ trong môi trường axit, thu được dung dịch X. Cho toàn bộ dung dịch X phản ứng hết với lượng dư dung dịch AgNO3 trong NH3, đun nóng, thu được m gam Ag. Giá trị của m là
A. 43,20 gam. B. 21,60 gam. C. 2,16 gam. D. 4,32 gam.
Câu 29: Thủy phân hoàn toàn 0,15 mol một este X (không chứa nhóm chức khác) cần dùng vừa đủ 100 gam dung dịch NaOH 18%, thu được một ancol và 36,9 gam hỗn hợp muối của hai axit cacboxylic đơn chức. Công thức phân tử của hai axit là:
A. CH3COOH và C2H5COOH. B. HCOOH và C3H7COOH.
C. C2H5COOH và C3H7COOH. D. HCOOH và C2H5COOH.
Câu 30: Đốt hoàn toàn 0,2 mol hỗn hợp X gồm etyl axetat và metyl acrylat thu được số mol CO2 nhiều hơn số mol H2O là 0,08 mol. Nếu đun 0,2 mol hỗn hợp X trên với 400 ml dd KOH 0,75M rồi cô cạn dung dịch sau phản ứng thì số gam chất rắn khan thu được là;
A. 20,56 B. 26,64 C. 26,16 D. 26,40
Câu 31: Hỗn hợp X gồm axit axetic, etyl axetat và metyl axetat. Cho m gam hỗn hợp X tác dụng vừa đủ với 200 ml dung dịch NaOH 1M. Mặt khác, đốt cháy hoàn toàn m gam hỗn hợp X cần V lít O2 (đktc) sau đó cho toàn bộ sản phẩm cháy vào dung dịch NaOH dư thấy khối lượng dung dịch tăng 40,3 gam. Giá trị của V là:
A. 19,04 lít B. 17,36 lít C. 15,12 lít D. 19,60 lít
Câu 32: Cho 0,3 mol hỗn hợp X gồm H2NC3H5(COOH)2 (axit glutamic) và (H2N)2C5H9COOH (lysin) vào 400 ml dung dịch HCl 1 M, thu được dung dịch Y. Y phản ứng vừa hết với 800 ml dung dịch NaOH 1 M. Số mol lysin trong 0,15 mol hỗn hợp X là
A. 0,1 B. 0,125 C. 0,2 D. 0,05
Câu 33: Cho 2,1 gam hỗn hợp X gồm 2 amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng phản ứng hết với dung dịch HCl (dư), thu được 3,925 gam hỗn hợp muối. Công thức của 2 amin trong hỗn hợp X là
A. C2H5NH2 và C3H7NH2. B. CH3NH2 và C2H5NH2.
C. CH3NH2 và (CH3)3N. D. C3H7NH2 và C4H9NH2.
Câu 34: Hỗn hợp X gồm C2H5OH, CH3COOCH3, CH3CHO, trong đó C2H5OH chiếm 50% về số mol. Khi đốt cháy hoàn toàn m gam hỗn hợp X thu được 3,06 gam H2O và 3,136 lít CO2 (đktc). Mặt khác, khi cho hỗn hợp X tác dung với lượng dư dung dịch AgNO3 trong NH3 thu được x gam bạc. Giá trị của x là:
A. 2,16 gam B. 8,68 gam C. 4,32 gam D. 1,08 gam
Câu 35: Hòa tan hết 13,52 gam hỗn hợp X gồm Mg(NO3)2, Al2O3, Mg và Al vào dung dịch NaNO3 và 1,08 mol HCl (đun nóng). Sau khi kết thức phản ứng thu được dung dịch Y chỉ chứa các muối và 3,136 lít (đktc) hỗn hợp khí Z gồm N2O và H2. Tỷ khối của Z so với He bằng 5. Dung dịch Y tác dụng tối đa với dung dịch chứa 1,14 mol NaOH, lấy kết tủa nung ngoài không khí tới khối lượng không đổi thu được 9,6 gam rắn. Phần trăm khối lượng của Al2O3 có trong hỗn hợp X là
A. 31,95%. B. 15,09% C. 23,96%. D. 27,96%.
Câu 36: Dung dịch X gồm NaHCO3 0,1M và K2CO3 0,2M. Dung dịch Y gồm HCl 0,4M và H2SO4 0,3M. Cho từ từ 20 ml dung dịch Y vào 60 ml dung dịch X, thu được dung dịch Z và V ml khí CO2 (đktc). Cho 150 ml dung dịch hỗn hợp KOH 0,1M và BaCl2 0,25M vào Z, thu được m gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V và m tương ứng là
A. 44,8 và 4,353. B. 179,2 và 3,368.
C. 44,8 và 4,550. D. 179,2 và 4,353.
Câu 37: Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO trong đó oxi chiếm 22,74% khối lượng hỗn hợp. Cho m gam hỗn hợp X tác dụng với 13,44 lít CO (điều kiện tiêu chuẩn) sau 1 thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉkhối so với hiđro là 20. Cho chất rắn Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 10,416 lít NO (điều kiện tiêu chuẩn, sản phẩm khử duy nhất). Cô cạn dung dịch T thu được 3,186m gam muối khan. m có giá trị gần nhất là:
A. 40 B. 48 C. 47 D. 46
Câu 38: Thủy phân m gam hỗn hợp X gồm một tetrapeptit A và một pentapeptit B (A và B mạch hở chứa đồng thời glyxin và alanin trong phân tử) bằng một lượng dung dịch NaOH vừa đủ rồi cô cạn thu được (m + 15,8) gam hỗn hợp muối. Đốt cháy toàn bộ lượng muối sinh ra bằng một lượng oxi vừa đủ thu được Na2CO3 và hỗn hợp hơi Y gồm CO2, H2O và N2. Dẫn toàn bộ hỗn hợp hơi Y đi qua bình đựng dung dịch NaOH đặc dư thấy khối lượng bình tăng thêm 56,04 gam so với ban đầu và có 4,928 lít một khí duy nhất (đktc) thoát ra khỏi bình. Xem như N2 không bị nước hấp thụ, các phản ứng xảy ra hoàn toàn. Thành phần phần trăm khối lượng của B trong hỗn hợp X là
A. 46,94%. B. 60,92% C. 58,92% D. 35,37%.
Câu 39: Tiến hành phản ứng đồng trùng hợp giữa stiren và buta – 1,3 – đien (butađien), thu được polime X. Cứ 2,834 gam X phản ứng vừa hết với 1,731 gam Br2. Tỉ lệ số mắt xích (butađien : stiren) trong loại polime trên là
A. 1 : 1. B. 1 : 2. C. 2 : 3. D. 1 : 3.
Câu 40: Khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol HCl ta có đồ thị biểu diễn sự phụ thuộc của khối lượng Mg vào thời gian phản ứng được biểu diễn như hình vẽ dưới đây:
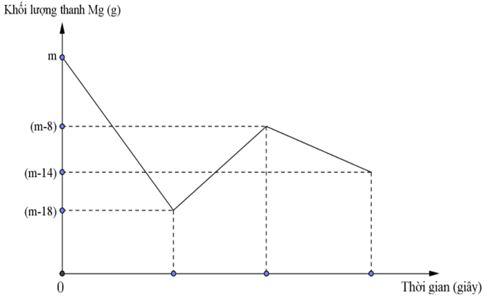
Sau khi phản ứng xảy ra hoàn toàn rút thanh Mg ra, thu được NO là sản phẩm khử duy nhất của N+5. Tỉ lệ a : b là
A. 1 : 10. B. 1 : 12. C. 1 : 8. D. 1 : 6.
Đáp án đề thi thử THPT Quốc gia năm 2017 môn Hóa học
|
Câu |
Đáp án |
Câu |
Đáp án |
Câu |
Đáp án |
|
1 |
B |
16 |
A |
31 |
B |
|
2 |
C |
`17 |
C |
32 |
A |
|
3 |
D |
18 |
D |
33 |
B |
|
4 |
A |
19 |
A |
34 |
B |
|
5 |
D |
20 |
B |
35 |
B |
|
6 |
A |
21 |
A |
36 |
B |
|
7 |
A |
22 |
C |
37 |
C |
|
8 |
D |
23 |
B |
38 |
A |
|
9 |
C |
24 |
A |
39 |
B |
|
10 |
D |
25 |
A |
40 |
A |
|
11 |
C |
26 |
C |
|
|
|
12 |
B |
27 |
A |
|
|
|
13 |
D |
28 |
D |
|
|
|
14 |
B |
29 |
B |
|
|
|
15 |
D |
30 |
C |
|

