Giải SBT Khoa học tự nhiên 8 Cánh diều bài 5
Giải sách bài tập Khoa học tự nhiên 8 bài 5: Tính theo phương trình hóa học sách Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 8.
Bài: Tính theo phương trình hóa học
Bài 5.1 trang 15 Sách bài tập KHTN 8: Đốt cháy hoàn toàn 1,24 gam phosphorus trong bình chứa 1,92 gam khí oxygen (ở đktc) tạo thành phosphorus pentoxide (P2O5). Khối lượng chất còn dư sau phản ứng là
A. 0,68 gam.
B. 0,64 gam.
C. 0,16 gam.
D. 0,32 gam.
Lời giải:
Đáp án đúng là: D
Phương trình hóa học: 4P + 5O2 →t0 2P2O5
Theo đề bài:
![]() \(np=\frac{m_P}{M_P}=\frac{1,24}{31}=0,04\ \left(mol\right)\)
\(np=\frac{m_P}{M_P}=\frac{1,24}{31}=0,04\ \left(mol\right)\)
![]() \(n_{O2}=\frac{m_{O2}}{M_{O2}}=\frac{1,92}{32}=0,06(mol)\)
\(n_{O2}=\frac{m_{O2}}{M_{O2}}=\frac{1,92}{32}=0,06(mol)\)
Theo phương trình hóa học: Cứ 4 mol P phản ứng với 5 mol O2,
Do đó 0,04 mol P phản ứng với 0,05 mol O2.
Vậy số mol O2 còn dư là 0,06 – 0,05 = 0,01 (mol).
Khối lượng O2 dư là 0,01 ´ 32 = 0,32 (gam)
Bài 5.2 trang 15 Sách bài tập KHTN 8: Cho 4,8 gam Mg tác dụng với dung dịch chứa 3,65 gam hydrochloric acid (HCl) thu được magnesium chloride (MgCl2) và khí hydrogen. Thể tích khí H2 thu được ở đkc là
A. 2,2400 lít.
B. 2,4790 lít.
C. 1,2395 lít.
D. 4,5980 lít.
Lời giải:
Đáp án đúng là: C
Phương trình hoá học: Mg + 2HCl → MgCl2 + H2
Theo bài ra:
![]() \(n_{Mg}=\frac{4,8}{24}=0,2mol;\)
\(n_{Mg}=\frac{4,8}{24}=0,2mol;\)
![]() \(m_{HCl}=\frac{3,65}{36,5}=0,1mol\)
\(m_{HCl}=\frac{3,65}{36,5}=0,1mol\)
Theo phương trình hoá học, cứ 1 mol Mg phản ứng với 2 mol HCl;
Do đó cứ 0,2 mol Mg phản ứng với 0,4 mol HCl.
Vậy Mg dư, HCl hết, số mol khí tính theo HCl.
![]() \(n_{H2}=\frac{1}{2}.n_{HCl}=\frac{1}{2}.0,1=0,05mol⇒V_{H2}=0,05.24,79=1,2395(L).\)
\(n_{H2}=\frac{1}{2}.n_{HCl}=\frac{1}{2}.0,1=0,05mol⇒V_{H2}=0,05.24,79=1,2395(L).\)
Bài 5.3 trang 15 Sách bài tập KHTN 8: Trong phòng thí nghiệm khí O2 được điều chế từ phản ứng nhiệt phân potassium permanganate (KMnO4):
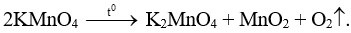
Đem nhiệt phân hoàn toàn 7,9 gam potassium permanganate thu được khối lượng khí O2 là
A. 0,2 gam.
B. 1,6 gam.
C. 0,4 gam.
D. 0,8 gam.
Lời giải:
Đáp án đúng là: D
![]() \(n_{KMnO4}=\frac{7,9}{158}=0,05mol.\)
\(n_{KMnO4}=\frac{7,9}{158}=0,05mol.\)
Theo phương trình hoá học cứ 2 mol KMnO4 phản ứng sinh ra 1 mol O2.
Vậy cứ 0,05 mol KMnO4 phản ứng sinh ra 0,025 mol O2.
Khối lượng khí O2 là: 0,25 × 32 = 0,8 gam.
Bài 5.4 trang 16 Sách bài tập KHTN 8: Nhiệt phân potassium chlorate (KClO3) thu được potassium chloride (KCl) và khí oxygen theo sơ đồ sau:
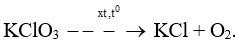
a) Hoàn thành phương trình hóa học của phản ứng trên.
b) Biết khối lượng potassium chlorate đem nung là 36,75 gam, thể tích khí oxygen thu được là 6,69 lít (ở đkc). Hiệu suất của phản ứng là
A. 54,73%.
B. 60,00%.
C. 90,00%.
D. 70,00%.
Lời giải:
a) 2KClO3 →xt,t0 2KCl + 3O2.
b) Đáp án đúng là: B
![]() \(n_{KClO3}=\frac{36,75}{122,5}=0,3(mol);\)
\(n_{KClO3}=\frac{36,75}{122,5}=0,3(mol);\)
![]() \(n_{O2}=\frac{6,69}{24,79}=0,27(mol)\)
\(n_{O2}=\frac{6,69}{24,79}=0,27(mol)\)
Theo phương trình hoá học cứ 2 mol KClO3 phản ứng thu được 3 mol O2.
Vậy 0,3 mol KClO3 phản ứng thu được 0,45 mol O2.
Hiệu suất phản ứng là:
![]() \(H=\frac{0,27}{0,45}.100\%=60\%.\)
\(H=\frac{0,27}{0,45}.100\%=60\%.\)
Bài 5.5 trang 16 Sách bài tập KHTN 8: Đốt cháy hoàn toàn a gam bột aluminium cần dùng hết 19,2 gam khí O2 và thu được b gam aluminium oxide (Al2O3) sau khi kết thúc phản ứng. Giá trị của a và b lần lượt là
A. 21,6 và 40,8.
B. 91,8 và 12,15.
C. 40,8 và 21,6.
D. 12,15 và 91,8.
Lời giải:
Đáp án đúng là: A
![]() \(n_{O2}=\frac{19,2}{32}=0,6(mol).\)
\(n_{O2}=\frac{19,2}{32}=0,6(mol).\)
Phương trình hoá học: 4Al + 3O2 →t02Al2O3
Theo phương trình hoá học cứ 3 mol O2 phản ứng hết với 4 mol Al.
Vậy 0,6 mol O2 phản ứng hết với 0,8 mol Al.
Giá trị của a = mAl = 0,8.27 = 21,6 gam.
Áp dụng định luật bảo toàn khối lượng có b = 21,6 + 19,2 = 40,8 gam.
Bài 5.6 trang 16 Sách bài tập KHTN 8: Đốt cháy than đá (thành phần chính là carbon) sinh ra khí carbon dioxide theo phương trình hóa học sau:
C + O2 ![]() \(\overset{to}{\rightarrow}\) CO2↑.
\(\overset{to}{\rightarrow}\) CO2↑.
Biết khối lượng than đá đem đốt là 30 gam, thể tích khí CO2 đo được (ở đktc) là 49,58 lít. Thành phần phần trăm về khối lượng của carbon trong than đá là
A. 40,00%.
B. 66,9%.
C. 80,0%.
D. 6,7%.
Lời giải:
Đáp án đúng là: C
C + O2 ![]() \(\overset{to}{\rightarrow}\) CO2↑.
\(\overset{to}{\rightarrow}\) CO2↑.
Theo đề bài:
![]() \(n_{CO2}=\frac{V_{CO2}}{24,79}=\frac{49,58}{24,79}=2(mol)\)
\(n_{CO2}=\frac{V_{CO2}}{24,79}=\frac{49,58}{24,79}=2(mol)\)
Theo phương trình hóa học:
![]() \(\frac{n_{CO2}}{nC}=\frac{1}{1}⇒n_C=n_{CO2}=2(mol)\)
\(\frac{n_{CO2}}{nC}=\frac{1}{1}⇒n_C=n_{CO2}=2(mol)\)
=> mC = 2 X 12 = 24 (gam).
![]() \(=>\%m_C=\frac{mC}{mthan}\times100\%=\frac{24}{30}\times100\%=80\%.\)
\(=>\%m_C=\frac{mC}{mthan}\times100\%=\frac{24}{30}\times100\%=80\%.\)
Bài 5.7 trang 16 Sách bài tập KHTN 8: Trong công nghiệp để sản xuất vôi sống (thành phần chính là CaO) người ta nung đá vôi (có thành phần chính là CaCO3) theo phương trình hóa học sau:
CaCO3 ![]() \(\overset{to}{\rightarrow}\) CaO + CO2↑
\(\overset{to}{\rightarrow}\) CaO + CO2↑
Tính khối lượng CaO thu được khi nung 1 tấn CaCO3 nếu hiệu suất phản ứng là
a) 100%. b) 90%.
Lời giải:
CaCO3 ![]() \(\overset{to}{\rightarrow}\)CaO + CO2
\(\overset{to}{\rightarrow}\)CaO + CO2
![]() \(n_{CaCO3}=\frac{m_{CaCO3}}{M_{CaCO3}}=\frac{1000000}{100}=10000(mol)\)
\(n_{CaCO3}=\frac{m_{CaCO3}}{M_{CaCO3}}=\frac{1000000}{100}=10000(mol)\)
a) Theo phương trình hóa học:
nCaO = 10000 mol => mCaO = 10000.56 = 560 000 (gam).
b) Do hiệu suất phản ứng là 90%:
![]() \(n_{CaO}=\frac{10000\times90}{100}=9000(mol)\)
\(n_{CaO}=\frac{10000\times90}{100}=9000(mol)\)
=> mCaO = 9 000 × 56 = 504 000 gam.
Bài 5.8 trang 16 Sách bài tập KHTN 8: Trong công nghiệp nhôm được sản xuất từ aluminium oxide (Al2O3) theo phương trình hóa học:
2Al2O3 ![]() \(\overset{cryolitedien phan nong chay}{\rightarrow}\)4Al + 3O2↑.
\(\overset{cryolitedien phan nong chay}{\rightarrow}\)4Al + 3O2↑.
Một loại quặng boxide có chứa 85% là Al2O3. Hãy tính khối lượng nhôm được tạo thành từ 2 tấn quặng boxide, biết hiệu suất của quá trình sản xuất là 90%.
Lời giải:
Trong 2 tấn quặng có:
![]() \(m_{Al2O3}=\frac{2\times85}{100}=1,7tấn.\)
\(m_{Al2O3}=\frac{2\times85}{100}=1,7tấn.\)
 \(⇒n_{Al2O3}=\frac{1,7\times10^6}{102}=500003(mol)\)
\(⇒n_{Al2O3}=\frac{1,7\times10^6}{102}=500003(mol)\)
Theo phương trình hóa học:
![]() \(\frac{n_{Al2O3}}{n_{Al}}=\frac{2}{4}=\frac{1}{2}⇒nAl=\frac{50000}{3}\times\frac{2}{1}=\frac{100000}{3}(mol)\)
\(\frac{n_{Al2O3}}{n_{Al}}=\frac{2}{4}=\frac{1}{2}⇒nAl=\frac{50000}{3}\times\frac{2}{1}=\frac{100000}{3}(mol)\)
![]() \(⇒m_{Al(lt)}=\frac{100000\times27}{3}=900000(gam)=900kg.\)
\(⇒m_{Al(lt)}=\frac{100000\times27}{3}=900000(gam)=900kg.\)
Do hiệu suất chỉ đạt 90% nên khối lượng nhôm thu được trong thực tế là:
![]() \(m_{Al(tt)}=900\times\frac{90}{100}=810(kg).\)
\(m_{Al(tt)}=900\times\frac{90}{100}=810(kg).\)
>>>> Bài tiếp theo: Giải SBT Khoa học tự nhiên 8 Cánh diều bài 6
Trên đây là toàn bộ lời giải Giải SBT KHTN lớp 8 bài 5: Tính theo phương trình hóa học sách Cánh diều. Các em học sinh tham khảo thêm KHTN lớp 8 Chân trời sáng tạo và KHTN lớp 8 Kết nối tri thức. VnDoc liên tục cập nhật lời giải cũng như đáp án sách mới của SGK cũng như SBT các môn cho các bạn cùng tham khảo.









