Giải SBT Khoa học tự nhiên 8 Cánh diều bài 12
VnDoc xin giới thiệu bài Giải sách bài tập Khoa học tự nhiên 8 bài 12: Muối sách Cánh diều chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 8.
Bài: Muối
Bài 12.1 trang 26 Sách bài tập KHTN 8: Trong các chất NaCl, Mg(OH)2, CaO, MgCO3, ZnCl2, KOH, CuSO4, NH4NO3, số lượng muối là
A. 3.
B. 4.
C. 5.
D. 6.
Lời giải:
Đáp án đúng là: C
Các chất là muối là: NaCl; MgCO3; ZnCl2; CuSO4; NH4NO3.
Bài 12.2 trang 27 Sách bài tập KHTN 8: Trong các muối NaCl; CaCO3; KNO3; BaSO4; CuSO4; AgCl; MgCO3 số lượng muối tan trong nước là
A. 3.
B. 4.
C. 5.
D. 6.
Lời giải:
Đáp án đúng là: A
Số lượng muối tan trong nước là 3, gồm: NaCl; KNO3; CuSO4.
Bài 12.3 trang 27 Sách bài tập KHTN 8: Viết công thức hóa học và ghi và tên gọi hai muối của mỗi acid HCl; H2SO4; HNO3.
Lời giải:
- Muối của HCl:
NaCl: Sodium chloride
FeCl2: Iron(II) chloride
- Muối của H2SO4:
MgSO4: Magnesium sulfate
K2SO4: Potassium sulfate
- Muối của HNO3:
Ca(NO3)2: Calcium nitrate
NaNO3: Sodium nitrate
Bài 12.4 trang 27 Sách bài tập KHTN 8: Có một số muối sau MgSO4; KNO3; Ca3(PO4)2; KCl.
a) Viết công thức hóa học của các acid tương ứng với các muối trên.
b) Viết tên gọi của các muối trên.
Lời giải:
a) Công thức hoá học của các acid tương ứng với lần lượt từng muối trên:
H2SO4, HNO3, H3PO4, HCl.
b) Tên gọi các muối:
MgSO4: Magnesium sulfate.
KNO3: Potassium nitrate.
Ca3(PO4)2: Calcium phosphate.
KCl: Potassium chloride.
Bài 12.5 trang 27 Sách bài tập KHTN 8: Cho các chất sau K2SO4; NaNO3; Ca(OH)2; CaCO3 KOH; HNO3; CO2; SO3; NaOH; H2O là các chất phản ứng và các chất sản phẩm của ba phản ứng hóa học khác nhau. Hãy viết ba phương trình hóa học từ các chất trên.
Lời giải:
Ba phương trình hoá học từ các chất đã cho:
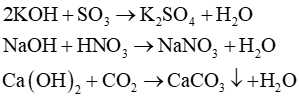
Bài 12.6 trang 27 Sách bài tập KHTN 8: Cho hai dung dịch muối NaCl; Na2CO3 lần lượt vào các dung dịch HCl; BaCl2.
a) Viết phương trình hóa học của các phản ứng xảy ra (nếu có).
b) Phản ứng nào tạo ra chất khí, phản ứng nào tạo ra chất kết tủa (không tan trong nước).
c) Dựa vào hiện tượng của các phản ứng trên, nêu cách phân biệt hai dung dịch muối NaCl và Na2CO3 bằng dung dịch HCl, dung dịch BaCl2.
Lời giải:
a) Các phương trình hoá học:
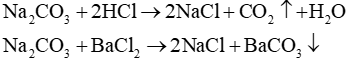
b) Cho dung dịch Na2CO3 vào dung dịch HCl thì có phản ứng hóa học xảy ra và tạo thành chất khí thoát ra khỏi dung dịch.
Cho dung dịch Na2CO3 vào dung dịch BaCl2 thì có phản ứng hóa học xảy ra và tạo thành chất không tan màu trắng.
c) Phân biệt hai dung dịch NaCl và Na2CO3 dựa vào các hiện tượng trên khi cho vào dung dịch HCl hoặc BaCl2.
Bài 12.7 trang 27 Sách bài tập KHTN 8: Chọn các chất thích hợp để điền vào vị trí dấu ? và hoàn thành các phương trình hóa học sau:
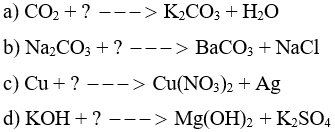
Lời giải:
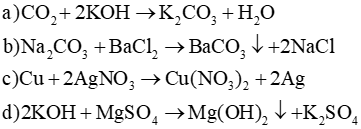
Bài 12.8 trang 27 Sách bài tập KHTN 8: Các chất A B C là các chất phản ứng chất sản phẩm trong các phản ứng sau
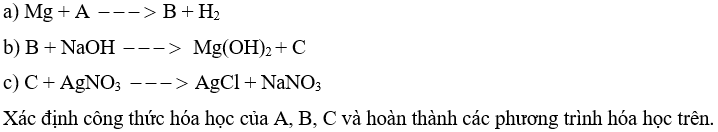
Lời giải:
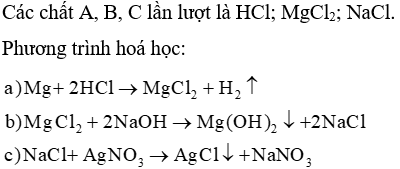
Bài 12.9 trang 27 Sách bài tập KHTN 8: Hoàn thành các phương trình hóa học theo sơ đồ chuyển hóa sau
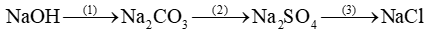
Lời giải:
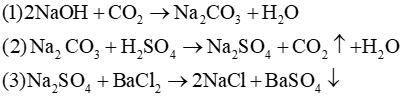
Bài 12.10 trang 28 Sách bài tập KHTN 8: Cho ba chất sau: Ba(OH)2, BaCl2 và BaCO3 Lập sơ đồ chuyển hóa giữa các chất trên và viết các phương trình hóa học phản ứng minh họa.
Lời giải:
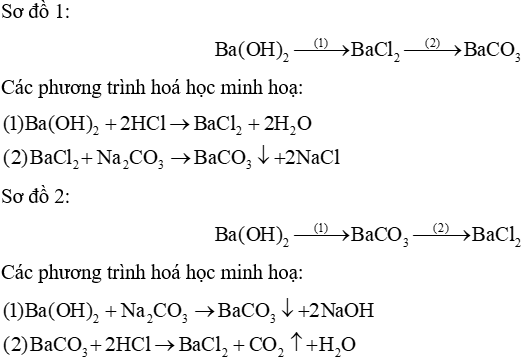
Bài 12.11 trang 28 Sách bài tập KHTN 8: Cho các chất sau Mg; MgCl2; MgO; Mg(OH)2 MgSO4.
a) Lập sơ đồ chuyển hóa giữa các chất trên.
b) Hoàn thành các phương trình hóa học theo sơ đồ chuyển hóa đã lập được.
Lời giải:
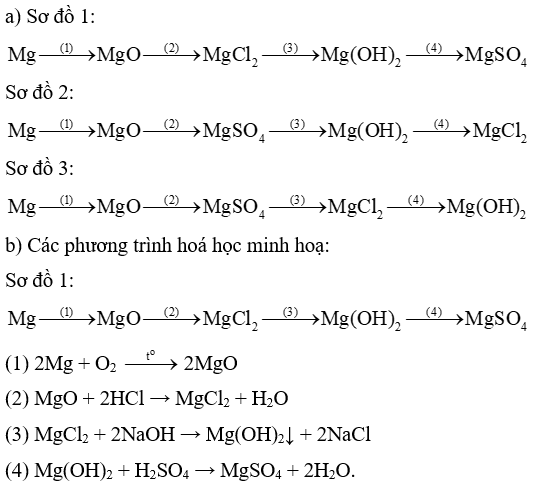
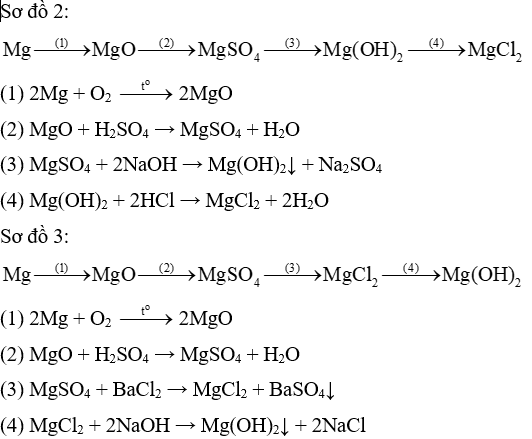
Bài 12.12 trang 28 Sách bài tập KHTN 8: Cho một chiếc đinh sắt vào 20 ml dung dịch CuSO4 0,1 M Sau khi phản ứng kết thúc, thấy có kim loại màu đỏ được tạo thành.
a) Viết phương trình hóa học của phản ứng xảy ra.
b) Giả sử CuSO4 trong dung dịch phản ứng hết, tính khối lượng kim loại màu đỏ được tạo ra.
Lời giải:
a) Phương trình hoá học xảy ra:
Fe + CuSO4 → FeSO4 + Cu
b) Theo phương trình hoá học: Cứ 1 mol CuSO4 phản ứng sinh ra 1 mol Cu.
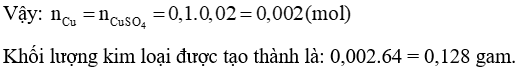
Bài 12.13 trang 28 Sách bài tập KHTN 8 :Cho 50 ml dung dịch Na2CO3 0,1 M tác dụng vừa đủ với dung dịch HCl 0,1 M, thu được dung dịch NaCl và khí CO2 thoát ra.
a) Tính thể tích dung dịch HCl đã dùng.
b) Tính thể tích khí CO2 (ở đkc) được tạo thành (coi hiệu suất phản ứng là 100%)
Lời giải:
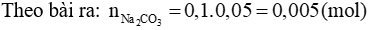
Phương trình hoá học:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
a) Theo phương trình hoá học, cứ 1 mol Na2CO3 phản ứng hết với 2 mol HCl.
Vậy cứ 0,005 mol Na2CO3 phản ứng hết với 0,01 mol HCl.
Thể tích của dung dịch HCl là 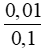 = 0,1 L = 100 ml.
= 0,1 L = 100 ml.
b) Theo phương trình hoá học, cứ 1 mol Na2CO3 phản ứng sinh ra 1 mol CO2.
Vậy cứ 0,005 mol Na2CO3 phản ứng sinh ra 0,005 mol CO2.
Thể tích của khí CO2 là: 0,005.24,79 = 0,12395 lít
>>>> Bài tiếp theo: Giải SBT Khoa học tự nhiên 8 Cánh diều bài 13
Trên đây là toàn bộ lời giải Giải SBT KHTN lớp 8 bài 12: Muối sách Cánh diều. Các em học sinh tham khảo thêm KHTN lớp 8 Chân trời sáng tạo và KHTN lớp 8 Kết nối tri thức. VnDoc liên tục cập nhật lời giải cũng như đáp án sách mới của SGK cũng như SBT các môn cho các bạn cùng tham khảo.








